上海交大张宏陆团队Sci. Adv.:框架核酸增强的单分子光镊技术
近日,上海交通大学自动化与感知学院副教授张宏陆与上海交通大学樊春海院士、美国加州大学伯克利分校Carlos Bustamante院士合作在Science Advances 杂志上发表研究论文,利用框架核酸增强的单分子光镊技术,结合 AlphaFold 结构分析,揭示了钙结合蛋白(CaE)紧凑多结构域蛋白的复杂折叠路径及“隐藏”中间态,为理解蛋白质折叠机制提供了新视角。
分析和阐明蛋白质如何正确折叠对理解其动态机制和相关疾病发生发展,开发疾病诊断和治疗方法至关重要。近年来,AlphaFold等深度学习方法在预测蛋白质静态结构方面取得了突破性进展,展示了人工智能在生命科学领域的应用(AI for Science)的巨大潜力。然而,现有的AI技术还难以对蛋白质折叠的动态过程进行准确预测。
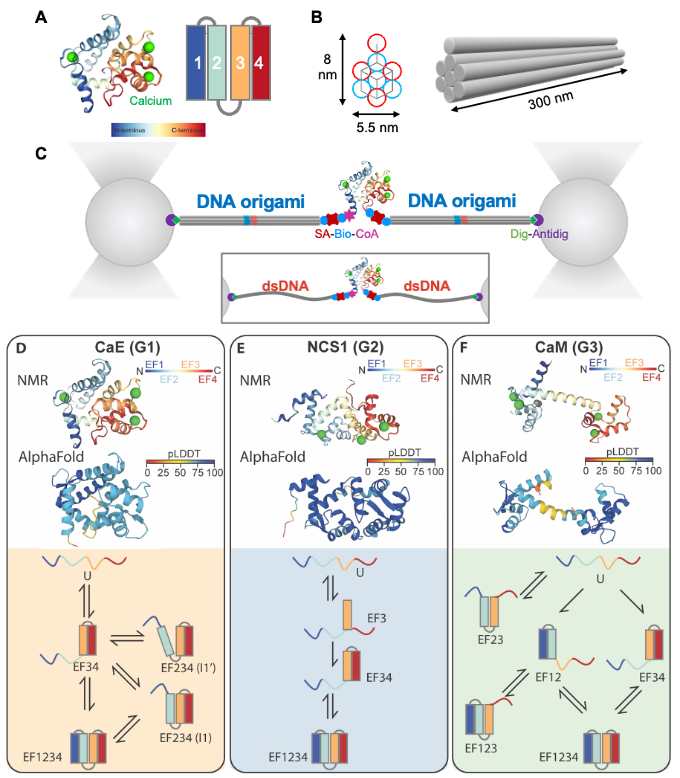
图1. 框架核酸增强光镊+AlphaFold揭示蛋白折叠动态图景。(A)钙结合蛋白CaE;(B)框架核酸刚性力学传感器;(C)单分子光镊操控装置;(D-F) 钙结合蛋白家族三类蛋白(CaE、NCS1和CaM)的结构预测和动态折叠路径。
研究团队利用DNA折纸术构建了具有六方密堆积排列的框架核酸结构,其力学刚性较传统双链DNA提升8倍,可取代后者作为高精度单分子力学传感器,显著提高光镊测量的时空分辨率,成功捕捉到以往研究中被忽略的钙结合蛋白折叠中间态。实验结果表明,框架核酸结构具有很高的机械刚性,可有效降低测量噪声。尤其在低力区域(<5 pN),测量信噪比可提升近一倍,这使研究人员能够实时观测蛋白质折叠和展开的全轨迹过程,包括瞬时随机出现的中间态。通过与AlphaFold结构预测相结合,研究团队对钙结合蛋白家族的折叠行为进行了系统比较分析。研究发现钙结合蛋白家族成员虽具有相似的EF-hand 结构基序,但因连接区域长度和柔性的差异,展现出独特的折叠路径和动力学特征。此外,该研究还发现钙结合蛋白内部的疏水相互作用、氢键网络等非共价相互作用对维持其稳定性和折叠路径起着关键作用。
该研究融合框架核酸单分子技术与深度学习驱动的结构预测方法,展现了AI for Science理念中实验技术与计算预测的协同优势,为解决复杂生命问题提供了新的研究范式,有望进一步推动人工蛋白质设计与合成生物学研究。
上海交通大学自动化与感知学院张宏陆副教授与美国斯坦福大学Cristhian Cañari-Chumpitaz 博士为论文的共同第一作者,上海交通大学张宏陆、樊春海教授与美国科学院院士、加州大学伯克利分校 Carlos Bustamante教授为论文的共同通讯作者。该研究工作受到国家重点研发计划、国家自然科学基金等项目的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

DNA origami–enhanced force spectroscopy and AlphaFold structural analyses reveal the folding landscape of calcium-binding proteins
Honglu Zhang*, Cristhian Cañari-Chumpitaz, Lisa Alexander, Huan Zhang, Chunhai Fan*, Carlos Bustamante*
Sci. Adv., 2025, DOI: 10.1126/sciadv.adv1962
研究团队
张宏陆研究团队长期致力于单分子生命感知、人工智能与合成生物学、DNA信息存储等研究,相关研究成果以第一/通讯作者发表于Science Advances、Nature Communications、PNAS、Matter、Nature Protocols等高水平学术期刊,申请发明专利十余项并积极开展颠覆性技术转化研究。欢迎感兴趣的本科生、研究生和博士后加入!
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























































 京公网安备 11010802027423号
京公网安备 11010802027423号